
下列液体均处于25℃,下列有关叙述正确的是( )
A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同
B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13
C.PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍
D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ·mol-1 B.+44.2kJ·mol-1
C.-330kJ·mol-1 D.+330kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是一种新型电子材料的原料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键更稳定(填“σ”或“π”)。
(2)NF3的沸点(154K)比NCl3(344K)低的原因是 。
(3)NF3是一种无色、无臭的气体,但NF3一旦在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
250C时,0.1mol·L-1稀醋酸加水稀释,如图中的纵坐标y可以是( )
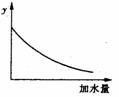
A.溶液的pH B.醋酸的电离平衡常数
C.溶液的导电能力 D.醋酸的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
反应mA(g)+ nB(g) 
 pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3 mol/L,又测得平均反应速率v(C)=2v(B)。达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
A.2A(g)+ 6B(g)
 3C(g)+5D(g)
3C(g)+5D(g)
B.3A(g)+ B(g)
 2C(g)+2D(g)
2C(g)+2D(g)
C.3A(g)+ B(g) 
 2C(g)+ D(g)
2C(g)+ D(g)
D.A(g)+ 3B(g)
 2C(g)+2D(g)
2C(g)+2D(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:

①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
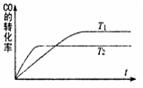
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) 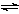 CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
A.T1>T2
B.该反应的△H >0
C.T1时的平衡常数K1> T2时的平衡常数K2
D.T1时的平衡常数K1< T2时的平衡常数K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com