
在某石灰水中通入适量CO2最多能生成20 g沉淀。问:
(1)求通入CO2的物质的量?石灰水中含Ca(OH)2多少克?
(2)再通入多少克CO2可使上述沉淀恰好溶解?
(1)0.2 mol;14.8 g
(2)8.8 g
Ca(OH)2溶液中通入适量的CO2,Ca(OH)2全部转化为CaCO3沉淀。若在CaCO3中通入过量的CO2,CO2与CaCO3反应生成Ca(HCO3)2被溶解。
(1)设通入的CO2物质的量为x,石灰水中含Ca(OH)2质量为y。
Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
74 g 1 mol 100 g
y x 20 g
解得:x=0.2 mol y=14.8 g
(2)设通入CO2质量为z,可使上述沉淀恰好溶解。
CaCO3+CO2+H2O![]() Ca(HCO
Ca(HCO![]() )
)![]()
100 g 44 g
20 g z
z=8.8 g
解此类题要注意量的关系,量不同,生成物不同。生成沉淀“最多”,说明CO2适量,使Ca2+全部变为CaCO3沉淀。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)通入的CO2为多少摩尔?石灰水中含Ca(OH)2多少克?
(2)再通入多少克CO2可使上述沉淀恰好溶解?
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市六校高三上学期期末联考理综化学试卷(解析版) 题型:选择题
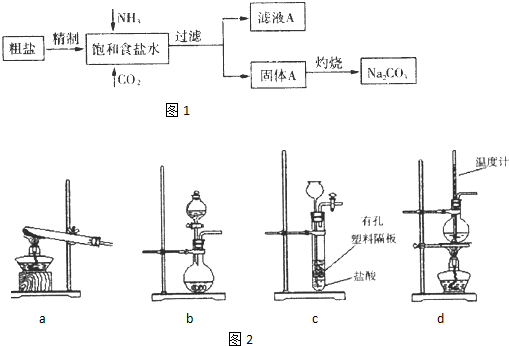
纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:

已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三4月巩固性训练理综化学试卷(解析版) 题型:实验题
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图

已知:向饱和食盐水中通入NH3,CO2后发生和反应为NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通人CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3在_____填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是__________________________________________________________。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+,K+的溶液中加入少量NH4HCO3。使pH降低,反应的离子方程式____________________________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂__________(填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2CO3·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案。(仪器自选)请把实验方案填全:供选择的试剂:1.0mol/LH2SO4溶液、1.0mol/L BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中。
②_________________________________________________________________。
③_________________________________________________________________。
④计算天然碱晶体中含Na2CO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com