
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | H2O/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L﹣1•mim﹣1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数不变
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
科目:高中化学 来源: 题型:多选题
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl,④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:填空题
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,△H= kJ·mol-1。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)  4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变 化关系如图.下列说法正确的是( )
化关系如图.下列说法正确的是( )

①若当温度升高后,则图中θ>45°
②若再加入B,则正、逆反应速率均逐渐增大
③若再加入B,则再次达到平衡时反应体系气体密度不变
④平衡时B的转化率为50%
A.①③ B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
深海中存在可燃冰(CH4•nH2O固体).已知:CH4•nH2O(s) 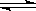 CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
CH4(g)+nH2O(l)﹣Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
A.低温高压 B.高温低压 C.低温低压 D.高温高压
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
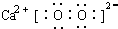 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1 kJ/mol | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2 kJ/mol | K2 | 2.38 | 1.72 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g)△H=QkJ/mol | K | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol•L-1Na2SO4溶液中Na+个数为2NA | |
| B. | 18g水含有电子数为10NA | |
| C. | 标准状况下,22.4LH2约含有2NA个H | |
| D. | 11.2LH2一定含有NA个H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com