
 4CO2(g)+N2(g)����H=��1200 kJ��mol��1
4CO2(g)+N2(g)����H=��1200 kJ��mol��1

 CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��
CO2(g)+H2(g) ��H<0��820 ��ʱ�ڼס��ҡ������������ܱ������У���ʼʱ�����ұ�����Ͷ�ϣ��ﵽƽ��״̬ʱK=1.0��| ��ʼ���ʵ��� | �� | �� | �� |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
 CO2(g)+H2(g)��ƽ�ⳣ��K�ı���ʽΪ
CO2(g)+H2(g)��ƽ�ⳣ��K�ı���ʽΪ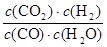 �����������ݻ�δ֪��Ϊ�˼�������̣������ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊx mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ���
�����������ݻ�δ֪��Ϊ�˼�������̣������ݻ�Ϊ1L����������CO�ı仯Ũ��Ϊx mol��L��1������÷�Ӧ�и���ֵģ���ʼ���仯��ƽ�⣩Ũ�ȣ��� CO2(g)+H2(g)
CO2(g)+H2(g)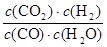 =
=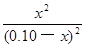 =1.0
=1.0 CO2(g)+H2(g)
CO2(g)+H2(g)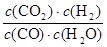 =
=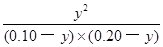 =1.0
=1.0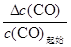 ��100%=
��100%=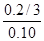 ��100%=67%>50%��
��100%=67%>50%�� CO2(g)+H2(g)
CO2(g)+H2(g)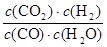 =
=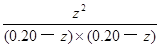 =1.0
=1.0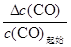 ��100%=
��100%=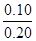 ��100%=50%��
��100%=50%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO(g) + H2O(g) ��H1����41.2kJ��moL��1��
CO(g) + H2O(g) ��H1����41.2kJ��moL��1�� CH3OH(g) + H2O(g) ��H2����49kJ��moL��1��
CH3OH(g) + H2O(g) ��H2����49kJ��moL��1��| �¶� | ת���ʣ�%�� | ���ʵ�����mol�� | ||
| H2 | CO2 | CH3OH | CO | |
| 240�� | | 10 | 0.05 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣�
2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ?2AB3��Ӧ��˵�����·�Ӧ���ʱ�ʾ��Ӧ�����ǣ� ��
?2AB3��Ӧ��˵�����·�Ӧ���ʱ�ʾ��Ӧ�����ǣ� ��| A��v(AB3)��0.5 mol/(L��min) | B��v(B2)��0.6 mol/(L��min) |
| C��v(A2)��0.4 mol/(L��min) | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g��+D��g������ij��ʱ���ڣ���A��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ2 mol/��L��s��������C��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ
2C��g��+D��g������ij��ʱ���ڣ���A��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ2 mol/��L��s��������C��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ| A��1 mol/��L��s�� | B��3 mol/��L��s�� |
| C��4 tool/��L��s�� | D��2 mol/��L��s�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���μӷ�Ӧ���ʵ������Ǿ�����ѧ��Ӧ���ʵ���Ҫ���� |
| B����ѧ��Ӧ����ֻ�ܼӿ첻�ܼ��� |
| C��������ѧ��Ӧ���ʵ���Ҫ������Ũ�� |
| D�����ӷ�Ӧ�������һ��������Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| c(H2)(mol��L-1) | c(Cl2)(mol��L-1) | v(mol��L-1��s-1) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
 ��n=
��n= C��m=
C��m= ��n=1 D��m=1��n=
��n=1 D��m=1��n=
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.3 mol��L-1s-1 | B��0.6 mol��L-1s-1 |
| C��1.0 mol��L-1s-1 | D��0.7 mol��L-1s-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com