
下列离子方程式正确的是
A.将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++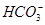 +OH- === CaCO3↓+H2O
+OH- === CaCO3↓+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++3H2S===Fe2S3↓+6H+
C.用稀硝酸浸泡做过银镜反应的试管:Ag+2H++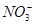 ===Ag++NO2↑+H2O
===Ag++NO2↑+H2O
D.4 mol·L-1的NaAlO2溶液和7 mol·L-1的HCl等体积互相均匀混合:4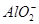 + 7H++ H2O===3Al(OH)3↓+ Al3+
+ 7H++ H2O===3Al(OH)3↓+ Al3+
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-和NO3-的相互分离。相应的实验过程如下:

下列关于四种试剂顺序正确的是
A.氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液
B.硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液
C.氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液
D.硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列各图与表述不一致的是
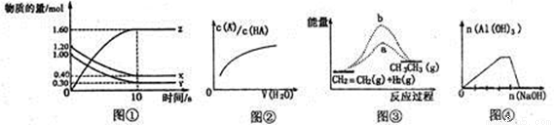
A. 图①表示T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线。若T℃时,若起始时X为1.20mol,Y为1.00mol,则平衡时Y的转化率为80%
B. 图②中曲线表示向弱酸HA的稀溶液中加水稀释
C. 图③b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g) △H<0,使用催化剂时,反应过程中的能量变化
D. 图④表示向NH4Al(SO4)2溶液中滴加过量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
下列物质中,当分子中一个氢原子被氯原子取代后,所得产物有两种同分异构体的是
A.甲烷 B.乙烷 C.丙烷 D.苯
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
有关电解质溶液的叙述,下列说法中正确的是
A.0.2 mol·L-1氨水中,c(OH-)与c(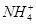 )相等
)相等
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合5 题型:简答题
A~G各物质间的关系如下图,其中B、D为气态单质.
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①若能在常温下进行,其化学方程式为________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G,检验G溶液中阳离子的常用试剂是________,实验现象为________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合3 题型:简答题
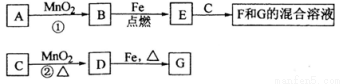
某课外活动小组同学用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 ,有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
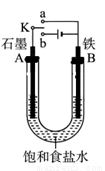
(3)该小组同学认为如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式? ? 。
查看答案和解析>>
科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A.9.6g B.6.4 g C.3.2 g D.2.4 g
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
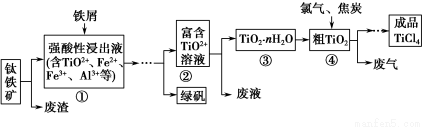
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+??Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com