
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。

(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ___________;Ⅱ___________;Ⅲ___________;
Ⅳ:浓溴水(将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明二氧化硫气体存在的现象是_______________________________。
(3)确证含有乙烯的现象是_________________________________________。
科目:高中化学 来源: 题型:
某研究小组以甲苯为主要原料,合成医药中间体F和Z。
②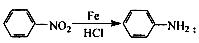 苯胺中氨基易被氧化。
苯胺中氨基易被氧化。
请回答下列问题:
(1)有机物A的结构简式为 。
(2)下列有关F的说法正确的是 。
a.分子式是C7H7NO2Br b.能形成内盐
c.能发生酯化反应和缩聚反应 d.1 mol的F最多可以和2 mol NaOH反应
(3)B→C的化学方程式是 。在合成F的过程中,B→C步骤不能省略,理由是 。
(4)写出同时符合下列条件的Z的同分异构体(不含Z,不考虑立体异构)。
①含有苯环结构 ②与Z含有相同官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下为无色液体,而且密度大于水的是
①苯②硝基苯③溴苯④溴乙烷⑤正己烷⑥四氯化碳⑦CH3Cl⑧丁烯⑨甲苯
A.②③④⑥; B.②③④⑥⑨; C.①②③④⑤⑥⑨; D.②③⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验溴乙烷中的溴元素,正确的实验方法是
A.加入氯水振荡,观察水层是否有棕红色出现
B.滴入硝酸银溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成
C.加入氢氧化钠溶液共热,然后,加入稀硝酸呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成
D.加入氢氧化钠溶液共热,冷却后滴入硝酸银溶液,观察有无浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
花青苷是引起花果呈现颜色的一种花色素, 广泛存在于植物中。它的主要结构在不同pH条件下有以下存在形式:


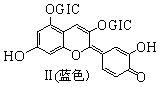 (GIC——葡萄糖基)
(GIC——葡萄糖基)
下列有关花青苷说法不正确的是 :
A.花青苷可作为一种酸碱指示剂 B.I和II中均含有二个苯环
C.I和II中除了葡萄糖基外,所有碳原子可能共平面
D.I和II均能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
元素W、X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4,M原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;X元素的最高正价与最低负价绝对值之差为2;N-、Z+、W+的半径逐渐减小;化合物WN常温下为气体,据此回答下列问题:
(1)W与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:_________________________________________。
(2)下图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:_________________。

(3)A、B均为由上述六种元素中的三种元素组成的强电解质,且组成元素的原子个数之比均为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的电子式是________。
(4)XY2与H2O反应的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
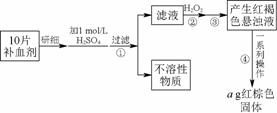
图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)右图所示的原电池装置中,其负极材料是 ,正极上能够观察到的现象是 ,正极的电极反应式是 。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
(2)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是________。工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。工作时,电解质溶液中阴离子移向_______极(填“正”或“负”)。电子流动方向为从_______极流向_______极(填“正”或“负”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com