
I£®·É»úβÆøÖеÄNO»áÆÆ»µ³ôÑõ²ã¡£ÀûÓôß
»¯¼Á¿ÉʹβÆøÖеÄNOºÍCO·¢Éú·´Ó¦2NO +2CO
![]() 2CO2£º+N2£»¡÷H<0¡£ÒÑÖªÔö´ó´ß»¯¼Á±È±íÃæ»ý¿ÉÌá¸ß»¯Ñ§·´Ó¦ËÙÂÊ¡£ÎªÁË·Ö±ðÑé֤ζȡ¢´ß»¯¼Á±È±íÃæ»ý£®¶Ô»¯Ñ§·´Ó¦ËÙÂʵÄÓ°Ïì¹æÂÉ£¬Ä³Í¬Ñ§Éè¼ÆÁËÈý×éʵÑ飬²¿·ÖʵÑéÌõ¼þÒѾÌîÔÚÏÂÃæʵÑéÉè¼Æ±íÖÐ
2CO2£º+N2£»¡÷H<0¡£ÒÑÖªÔö´ó´ß»¯¼Á±È±íÃæ»ý¿ÉÌá¸ß»¯Ñ§·´Ó¦ËÙÂÊ¡£ÎªÁË·Ö±ðÑé֤ζȡ¢´ß»¯¼Á±È±íÃæ»ý£®¶Ô»¯Ñ§·´Ó¦ËÙÂʵÄÓ°Ïì¹æÂÉ£¬Ä³Í¬Ñ§Éè¼ÆÁËÈý×éʵÑ飬²¿·ÖʵÑéÌõ¼þÒѾÌîÔÚÏÂÃæʵÑéÉè¼Æ±íÖÐ
| ʵÑé±àºÅ | T£¨¡æ£© | NO³õʼŨ¶È£¨mol/L£© | CO³õʼŨ¶È£¨mol/L£© | ´ß»¯¼ÁµÄ±È±íÃæ»ý£¨m2/g£© |
| ¢ñ | 280 | 1.20¡Á10-3 | 5.80¡Á10-3 | 82 |
| ¢ò | 1.20¡Á10-3 | 124 | ||
| ¢ó | 350 | 5.80¡Á10-3 |
£¨1£©ÇëÌîÈ«±íÖеĸ÷¿Õ¸ñ¡£
£¨2£©ÇëÔÚÓұ߸ø³öµÄ×ø±êͼÖУ¬»³öÉϱíÖеÄÈý
 ¸öʵÑéÌõ¼þÏ»ìºÏÆøÌåÖÐNOŨ¶ÈËæʱ¼ä±ä
¸öʵÑéÌõ¼þÏ»ìºÏÆøÌåÖÐNOŨ¶ÈËæʱ¼ä±ä
»¯µÄÇ÷ÊÆÇúÏßͼ£¬²¢±êÃ÷¸÷ÌõÇúÏßµÄʵÑé±àºÅ¡£
II£®Æû³µÄÚȼ»ú¹¤×÷ʱ²úÉúµÄ¸ßλáÒýÆðN2ºÍO2µÄ·´Ó¦£º
N2£¨g£©+O2£¨g£©![]() =2NO£¨g£©Êǵ¼ÖÂÆû³µÎ²Æø
=2NO£¨g£©Êǵ¼ÖÂÆû³µÎ²Æø
Öк¬ÓÐNOµÄÔÒòÖ®Ò»¡£
2000Cʱ£¬ÏòÈÝ»ýΪ2LµÄÃܱÕÈÝÆ÷ÖгäÈë10molN2Óë5mol O2£¬´ïµ½Æ½ºâºóNOµÄÎïÖʵÄÁ¿Îª2mol£¬Ôò¸Ã·´Ó¦µÄƽºâ³£ÊýK=___ _ ¡£¸ÃζÈÏ£¬Èô¿ªÊ¼Ê±ÏòÉÏÊöÈÝÆ÷ÖгäÈë1 molN2ºÍÒ»¶¨Á¿µÄO2£¬Æ½ºâʱO2ÓëNOµÄÎïÖʵÄÁ¿Ç¡ºÃÏàµÈ£¬Ôòƽ ºâʱN2µÄÎïÖʵÄÁ¿ÊÇ ¡£
 Ãûʦָµ¼ÆÚÄ©³å´Ì¾íϵÁдð°¸
Ãûʦָµ¼ÆÚÄ©³å´Ì¾íϵÁдð°¸ ¿ªÐÄÍÜ¿ÚËãÌ⿨ϵÁдð°¸
¿ªÐÄÍÜ¿ÚËãÌ⿨ϵÁдð°¸
| Ä꼶 | ¸ßÖÐ¿Î³Ì | Ä꼶 | ³õÖÐ¿Î³Ì |
| ¸ßÒ» | ¸ßÒ»Ãâ·Ñ¿Î³ÌÍƼö£¡ | ³õÒ» | ³õÒ»Ãâ·Ñ¿Î³ÌÍƼö£¡ |
| ¸ß¶þ | ¸ß¶þÃâ·Ñ¿Î³ÌÍƼö£¡ | ³õ¶þ | ³õ¶þÃâ·Ñ¿Î³ÌÍƼö£¡ |
| ¸ßÈý | ¸ßÈýÃâ·Ñ¿Î³ÌÍƼö£¡ | ³õÈý | ³õÈýÃâ·Ñ¿Î³ÌÍƼö£¡ |
¿ÆÄ¿£º¸ßÖл¯Ñ§ À´Ô´£º ÌâÐÍ£º
| ´ß»¯¼Á |
| ʱ¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c£¨NO£©/mol?L-1 | 1.00¡Á10-3 | 4.50¡Á10-4 | 2.50¡Á10-4 | 1.50¡Á10-4 | 1.00¡Á10-4 | 1.00¡Á10-4 |
| c£¨CO£©/mol?L-1 | 3.60¡Á10-3 | 3.05¡Á10-3 | 2.85¡Á10-3 | 2.75¡Á10-3 | 2.70¡Á10-3 | 2.70¡Á10-3 |

²é¿´´ð°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖл¯Ñ§ À´Ô´£º2013½ìºþÄÏÊ¡»³»¯ÊиßÈýÉÏѧÆÚÆÚÄ©¿¼ÊÔ»¯Ñ§ÊÔ¾í£¨´ø½âÎö£© ÌâÐÍ£ºÌî¿ÕÌâ
I¡¢³¬ÒôËÙ·É»úÔÚƽÁ÷²ã·ÉÐÐʱ£¬Î²ÆøÖеÄNO»áÆÆ»µ³ôÑõ²ã¡£¿Æѧ¼ÒÕýÔÚÑо¿ÀûÓô߻¯¼¼Êõ´¦ÀíβÆø£¬»¯Ñ§·½³ÌʽΪ2NO + 2CO 2CO2 + N2£¬ÎªÁ˲ⶨÔÚijÖÖ´ß»¯¼Á×÷ÓÃϵķ´Ó¦ËÙÂÊ£¬ÔÚijζÈÏÂÓÃÆøÌå´«¸ÐÆ÷²âµÃ²»Í¬Ê±¼äµÄNOºÍCOŨ¶ÈÈçÏÂ±í£º
2CO2 + N2£¬ÎªÁ˲ⶨÔÚijÖÖ´ß»¯¼Á×÷ÓÃϵķ´Ó¦ËÙÂÊ£¬ÔÚijζÈÏÂÓÃÆøÌå´«¸ÐÆ÷²âµÃ²»Í¬Ê±¼äµÄNOºÍCOŨ¶ÈÈçÏÂ±í£º
| ʱ¼ä/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol¡¤L£1 | 1.00¡Á10£3 | 4.50¡Á 10£4 | 2.50¡Á10£4 | 1.50¡Á10£4 | 1.00¡Á10£4 | 1.00¡Á10£4 |
| c(CO)/mol¡¤L£1 | 3.60¡Á10£3 | 3.05¡Á10£3 | 2.85¡Á10£3 | 2.75¡Á10£3 | 2.70¡Á10£3 | 2.70¡Á10£3 |
²é¿´´ð°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖл¯Ñ§ À´Ô´£º2012-2013ѧÄêºþÄÏÊ¡»³»¯ÊиßÈýÉÏѧÆÚÆÚÄ©¿¼ÊÔ»¯Ñ§ÊÔ¾í£¨½âÎö°æ£© ÌâÐÍ£ºÌî¿ÕÌâ
I¡¢³¬ÒôËÙ·É»úÔÚƽÁ÷²ã·ÉÐÐʱ£¬Î²ÆøÖеÄNO»áÆÆ»µ³ôÑõ²ã¡£¿Æѧ¼ÒÕýÔÚÑо¿ÀûÓô߻¯¼¼Êõ´¦ÀíβÆø£¬»¯Ñ§·½³ÌʽΪ2NO + 2CO 2CO2 + N2£¬ÎªÁ˲ⶨÔÚijÖÖ´ß»¯¼Á×÷ÓÃϵķ´Ó¦ËÙÂÊ£¬ÔÚijζÈÏÂÓÃÆøÌå´«¸ÐÆ÷²âµÃ²»Í¬Ê±¼äµÄNOºÍCOŨ¶ÈÈçÏÂ±í£º
2CO2 + N2£¬ÎªÁ˲ⶨÔÚijÖÖ´ß»¯¼Á×÷ÓÃϵķ´Ó¦ËÙÂÊ£¬ÔÚijζÈÏÂÓÃÆøÌå´«¸ÐÆ÷²âµÃ²»Í¬Ê±¼äµÄNOºÍCOŨ¶ÈÈçÏÂ±í£º
|
ʱ¼ä/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol¡¤L£1 |
1.00¡Á10£3 |
4.50¡Á 10£4 |
2.50¡Á10£4 |
1.50¡Á10£4 |
1.00¡Á10£4 |
1.00¡Á10£4 |
|
c(CO)/mol¡¤L£1 |
3.60¡Á10£3 |
3.05¡Á10£3 |
2.85¡Á10£3 |
2.75¡Á10£3 |
2.70¡Á10£3 |
2.70¡Á10£3 |
Çë»Ø´ð£¨¾ù²»¿¼ÂÇζȱ仯¶Ô´ß»¯Ð§ÂʵÄÓ°Ï죩£º
£¨1£©ÈôÉÏÊö·´Ó¦µÄƽºâ³£ÊýK£¬ËæζÈÔö¸ß¶ø¼õС£¬Ôò·´Ó¦µÄ¦¤H 0(Ìî¡°£¾¡±¡¢¡°£¼¡±»ò¡°£½¡±)¡£
£¨2£©Ç°2sÄÚµÄƽ¾ù·´Ó¦ËÙ¶Èv (N2)£½ ¡£
£¨3£©¸ÃζÈÏ£¬·´Ó¦µÄƽºâ³£ÊýK£½ ¡£
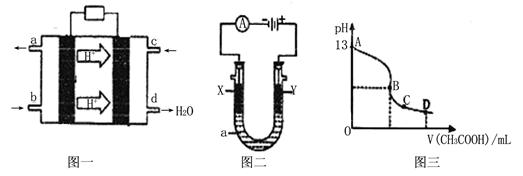
II¡¢¼×´¼¿ÕÆøȼÁϵç³Ø£¨ËáÐÔµç½âÖÊÈÜÒº£©µÄ¹¤×÷ÔÀíÈçÏÂͼһËùʾ¡£
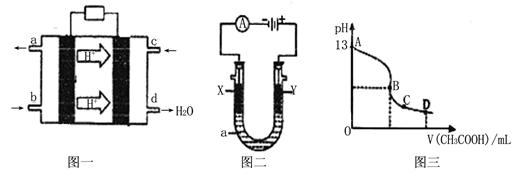
(1)¸Ãµç³ØÕý¼«µÄµç¼«·´Ó¦Ê½Îª ¡£
(2)ÒÔÉÏÊöµç³ØΪµçÔ´£¬¹¹³Éͼ¶þµç½â³Ø £¬ÆäÖÐX¡¢YΪʯī£¬aΪKClÈÜÒº£¬Ð´³öµç½â×Ü·´Ó¦µÄÀë×Ó·½³Ìʽ ¡£
(3)³£ÎÂʱ£¬°´¡°(2)¡±µç½âÒ»¶Îʱ¼äºó£¬È¡25mLÉÏÊöµç½âºóµÄÈÜÒº£¬µÎ¼Ó0.2mol/LµÄ´×ËáÈÜÒº£¬µÎ¼Ó¹ý³ÌµÄpH±ä»¯ÈçͼÈýËùʾ£¬ÔòCµã¶ÔÓ¦ÈÜÒºÖи÷Àë×ÓŨ¶ÈµÄ´óС¹ØϵΪ£¨ºöÂÔµç½âºóÈÜÒºÖеÄÆäËû³É·Ö£¬Ö»¿¼ÂÇÆäÖеļîÓë¼ÓÈëµÄËá £© ¡¡¡¡ ¡£
²é¿´´ð°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖл¯Ñ§ À´Ô´£º ÌâÐÍ£º
I£®·É»úβÆøÖеÄNO»áÆÆ»µ³ôÑõ²ã¡£ÀûÓôß
»¯¼Á¿ÉʹβÆøÖеÄNOºÍCO·¢Éú·´Ó¦2NO +2CO![]() 2CO2£º+N2£»¡÷H<0¡£ÒÑÖªÔö´ó´ß»¯¼Á±È±íÃæ»ý¿ÉÌá¸ß»¯Ñ§·´Ó¦ËÙÂÊ¡£ÎªÁË·Ö±ðÑé֤ζȡ¢´ß»¯¼Á±È±íÃæ»ý£®¶Ô»¯Ñ§·´Ó¦ËÙÂʵÄÓ°Ïì¹æÂÉ£¬Ä³Í¬Ñ§Éè¼ÆÁËÈý×éʵÑ飬²¿·ÖʵÑéÌõ¼þÒѾÌîÔÚÏÂÃæʵÑéÉè¼Æ±íÖÐ
2CO2£º+N2£»¡÷H<0¡£ÒÑÖªÔö´ó´ß»¯¼Á±È±íÃæ»ý¿ÉÌá¸ß»¯Ñ§·´Ó¦ËÙÂÊ¡£ÎªÁË·Ö±ðÑé֤ζȡ¢´ß»¯¼Á±È±íÃæ»ý£®¶Ô»¯Ñ§·´Ó¦ËÙÂʵÄÓ°Ïì¹æÂÉ£¬Ä³Í¬Ñ§Éè¼ÆÁËÈý×éʵÑ飬²¿·ÖʵÑéÌõ¼þÒѾÌîÔÚÏÂÃæʵÑéÉè¼Æ±íÖÐ
ʵÑé±àºÅ | T£¨¡æ£© | NO³õʼŨ¶È£¨mol/L£© | CO³õʼŨ¶È£¨mol/L£© | ´ß»¯¼ÁµÄ±È±íÃæ»ý£¨m2/g£© |
¢ñ | 280 | 1.20¡Á10-3 | 5.80¡Á10-3 | 82 |
¢ò | 1.20¡Á10-3 | 124 | ||
¢ó | 350 | 5.80¡Á10-3 |
¡¡ £¨1£©ÇëÌîÈ«±íÖеĸ÷¿Õ¸ñ¡£
¡¡ £¨2£©ÇëÔÚÓұ߸ø³öµÄ×ø±êͼÖУ¬»³öÉϱíÖеÄÈý
 ¸öʵÑéÌõ¼þÏ»ìºÏÆøÌåÖÐNOŨ¶ÈËæʱ¼ä±ä
¸öʵÑéÌõ¼þÏ»ìºÏÆøÌåÖÐNOŨ¶ÈËæʱ¼ä±ä
»¯µÄÇ÷ÊÆÇúÏßͼ£¬²¢±êÃ÷¸÷ÌõÇúÏßµÄʵÑé±àºÅ¡£
II£®Æû³µÄÚȼ»ú¹¤×÷ʱ²úÉúµÄ¸ßλáÒýÆðN2ºÍO2µÄ·´Ó¦£º
N2£¨g£©+O2£¨g£©![]() =2NO£¨g£©Êǵ¼ÖÂÆû³µÎ²ÆøÖк¬ÓÐNOµÄÔÒòÖ®Ò»¡£
=2NO£¨g£©Êǵ¼ÖÂÆû³µÎ²ÆøÖк¬ÓÐNOµÄÔÒòÖ®Ò»¡£
2000Cʱ£¬ÏòÈÝ»ýΪ2LµÄÃܱÕÈÝÆ÷ÖгäÈë10molN2Óë5mol O2£¬´ïµ½Æ½ºâºóNOµÄÎïÖʵÄÁ¿Îª2mol£¬Ôò¸Ã·´Ó¦µÄƽºâ³£ÊýK=___ ¡¡¡¡¡¡¡¡¡¡ _ ¡£¸ÃζÈÏ£¬Èô¿ªÊ¼Ê±ÏòÉÏÊöÈÝÆ÷ÖгäÈë1 molN2ºÍÒ»¶¨Á¿µÄO2£¬Æ½ºâʱO2ÓëNOµÄÎïÖʵÄÁ¿Ç¡ºÃÏàµÈ£¬Ôòƽ ºâʱN2µÄÎïÖʵÄÁ¿ÊÇ¡¡¡¡¡¡ ¡£
²é¿´´ð°¸ºÍ½âÎö>>
¹ú¼ÊѧУÓÅÑ¡ - Á·Ï°²áÁбí - ÊÔÌâÁбí
ºþ±±Ê¡»¥ÁªÍøÎ¥·¨ºÍ²»Á¼ÐÅÏ¢¾Ù±¨Æ½Ì¨ | ÍøÉÏÓк¦ÐÅÏ¢¾Ù±¨×¨Çø | µçÐÅթƾٱ¨×¨Çø | ÉæÀúÊ·ÐéÎÞÖ÷ÒåÓк¦ÐÅÏ¢¾Ù±¨×¨Çø | ÉæÆóÇÖȨ¾Ù±¨×¨Çø
Î¥·¨ºÍ²»Á¼ÐÅÏ¢¾Ù±¨µç»°£º027-86699610 ¾Ù±¨ÓÊÏ䣺58377363@163.com