
(6分)在一定条件下进行如下反应:aX(g)+bY(g) cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
cZ(g),如图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强的关系示意图。
(1)写出该反应的化学平衡常数表达式:K= 。随着温度的升高,K值 (填”增大”“减小”或”不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明 (填序号)。
| A.X的转化率越高 | B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 | D.化学反应速率越快 |
(6分)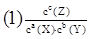 减小 AB(2分) (2)> <
减小 AB(2分) (2)> <
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据化学方程式可知,该反应的平衡常数K=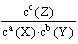 。根据图像可知,温度越高,Z的含量越低。这说明升高温度,平衡向逆反应方向移动,所以正反应是放热反应。因此随着温度的升高,K值减小。根据概念可知,当反应物起始浓度相同时,平衡常数K值越大,表明该可逆反应的正向程度越大,反应进行的越完全,所以答案选AB。
。根据图像可知,温度越高,Z的含量越低。这说明升高温度,平衡向逆反应方向移动,所以正反应是放热反应。因此随着温度的升高,K值减小。根据概念可知,当反应物起始浓度相同时,平衡常数K值越大,表明该可逆反应的正向程度越大,反应进行的越完全,所以答案选AB。
(2)根据图像可知,甲是保持温度和容积不变的,乙是保持温度和压强不变的,因此在反应过程中,乙中的压强始终大于甲中的压强,所以甲中的反应速率小,达到平衡的时间长。但由于正反应是体积减小的,所以压强越大,反应式的转化率越高。
考点:考查外界条件对平衡状态的影响、平衡常数的有关判断和应用等
点评:在可逆反应的有关图像识别中,需要注意的是:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:

| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一密闭容器中充入X和Y,在一定条件下进行如下反应:aX(g)+bY(g)
在一密闭容器中充入X和Y,在一定条件下进行如下反应:aX(g)+bY(g)  cZ(g)+dW(s),如图I是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系的示意图,下列说法中正确的是( )
cZ(g)+dW(s),如图I是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系的示意图,下列说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之间.土壤中Na2CO3含量较高时,pH可以高达10.5, HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH- HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-| cc(Z) |
| ca(X)?cb(Y) |
| cc(Z) |
| ca(X)?cb(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
| H | + 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 试验编号 | ① | ② | ③ |
| 所加0.4moL/LH2SO4 溶液的体积 | 30mL | ||
| 所加0.2 moL/LCuSO4溶液的体积 | 0 | 0.5mL | 5mL |
| 所加蒸馏水的体积 | 5mL | ||
| 探究硫酸铜对硫酸与锌反应速率的影响 | . | ||
| 设计实验室应注意的问题 | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com