
| |||||||||||
(1) |
当Cu与Fe2O3物质的量相等,因有关系式Fe2O3 另一极端是不存在Cu(实际上不是这样),此时n(Fe2O3)= 因此V的取值范围为0.3≤V<0.42. |
(2) |
由于反应后Fe2+为0.1 mol,由题给离子方程式推知原Cu 0.05 mol(即3.2 g). 另一种情况是Fe2O3量不足,Fe2O3全溶于H2SO4但产生的Fe3+不足以使Cu全溶.此时Fe2O3为0.05 mol,质量为8 g(因为Fe守恒),推知Cu质量为22.4 g-8 g=14.4 g. |
|
这是一道关于Fe化合物的综合计算. |


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:

| 浓硫酸 |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| Cu |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |
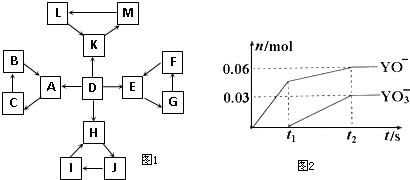
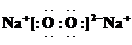
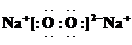
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
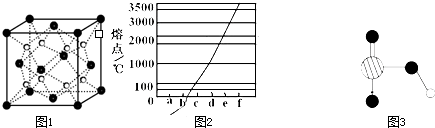
查看答案和解析>>
科目:高中化学 来源:2014届江西省高三上学期第二次月考化学试卷(解析版) 题型:填空题
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。
 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为 (填选项标号)。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是 。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为 。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为 ,②后又变黑色沉淀的离子方程式为 。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+= Cu+ Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式 。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com