
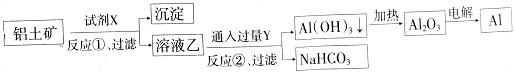
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为Fe2O3 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液 |
科目:高中化学 来源:不详 题型:填空题
 |
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
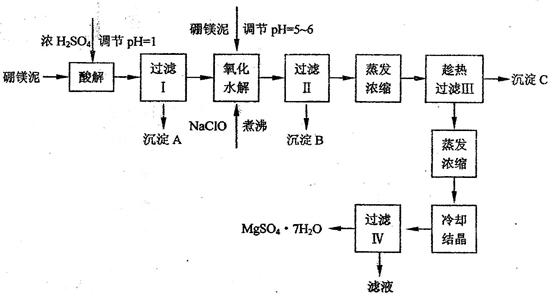
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.7g | B.3.6g | C.5.4g | D.1.8g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
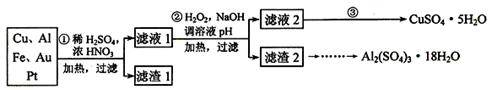
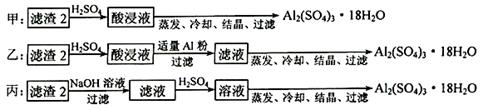
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com