
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。
工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:
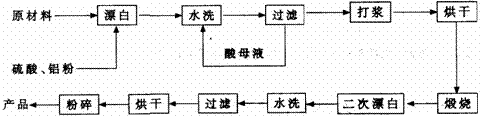
(1)在该流程中,为加快“漂白”速度,采取的措施有 、 。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
。
(4)二次漂白前,煅烧的主要目的是 。
(5)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
(6)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①通入过量氧化剂(Cl2),其目的是 。
②加入适量NaOH来调节溶液的pH ,其目的是 ,
调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.8 |
4.7 |
|
Mn2+ |
8.3 |
9.8 |
③最后通过 、 、灼烧得到氧化铁。
科目:高中化学 来源: 题型:阅读理解

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色,工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混台加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶子填料的生产工艺流程为:
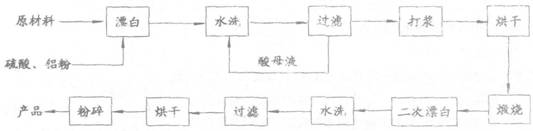
(1)在该流程中,为加快“浮白”速度,可采取的措施有
.
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式: 。
(3)铝粉也起到了“漂白”的作用。你认为,铝粉是如何起到该作用的? ;有同学认为,既然两次水洗,那么铝粉的作用就不大。你的解释是: 。
(4)煅烧的主要目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。
工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。已知MnO是碱性氧化物,Al粉可以将深色的Fe3+转化为浅色的Fe2+。
重晶石填料的生产工艺流程为:

(1)在该流程中,为加快“漂白”速度,采取的措施有 、 。
(2)硫酸起到了“漂白”的作用。请写出硫酸直接起到该作用时的化学方程式:
、 。
(3)二次漂白水洗过滤后,检验滤渣不含Fe2+离子的方法是
。
(4)二次漂白前,煅烧的主要目的是 。
(5)将煅烧后的固体磨细,使用的是加有刚玉(氧化铝)球的振动磨。这说明刚玉具有很高的 。
(6)工业生产中为了充分利用资源,将滤液经过处理得到化工原料Fe2O3。操作过程是:
①通入过量氧化剂(Cl2),其目的是 。
②加入适量NaOH来调节溶液的pH ,其目的是 ,
调节溶液的pH范围为 。
有关离子开始沉淀及完全沉淀时的pH如下:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
③最后通过 、 、灼烧得到氧化铁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com