
| A. | 氧化铁溶于水生成红褐色沉淀 | |
| B. | 钠在空气中燃烧,发出黄色的火焰,生成白色固体 | |
| C. | 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾 | |
| D. | 铜在氯气中燃烧,产生棕黄色烟 |
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为 285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(g)△H=-Q2kJ/mol,则 Q1>Q2 | |
| D. | 已知中和热为 57.3 kJ/mol,若将含 0.5molH2SO4的浓溶液与含 1molNaOH 的溶液混合,放出的热量等于 57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | Z分别与X、Y形成的化合物中,化学键类型均相同 | |
| C. | X分别与Y、W形成的最简单化合物的稳定性:W<Y | |
| D. | 由以上四种元素形成的化合物一定能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后向容器中再充入与初始投料相同物质的量的CO2和H2,则CO的平衡浓度变为原来的2倍 | |
| B. | 恒温恒容下,增大压强,H2的浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为:CO2(g)+H2(g)?CO(g)+H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短时间存放FeCl2溶液时,可添加少量铁粉防止Fe2+被氧化 | |
| B. | Na2CO3溶液存放在带玻璃塞的玻璃试剂瓶中 | |
| C. | 氢氟酸存放在玻璃试剂瓶中 | |
| D. | 钠单质存放在四氯化碳中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
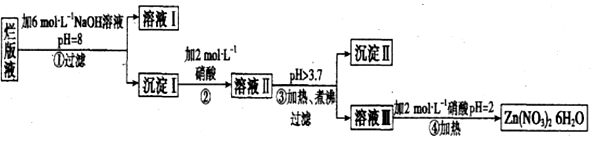
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com