
【题目】以下反应会导致溶液导电性减弱最明显的是( )
A. Na2SO4溶液加入BaCl2固体
B. Ba(OH)2溶液中加入CuSO4(少量)固体
C. NaOH溶液通入HCl
D. H2O中加入NaCl固体
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如右过程生成NH3(g):
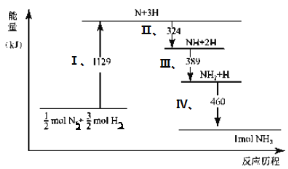
下列说法正确的是( )
A.Ⅰ中1129KJ为该反应过程的活化能
B.N2(g)+3H2(g)![]() 2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
2NH3(g) ΔH=2(324+389+460-1129)kJ/mol
C.Ⅱ、Ⅲ、Ⅳ均为放热过程
D.N2(g)+3H2(g)![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是

A.容器中发生的反应可表示为:3X(g)+Y(g) ![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- =34CO2+10H2O。
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
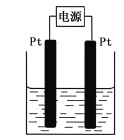
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
①写出反应的离子方程式 。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40 mol NO2气体充入2 L的密闭容器中,发生如下反应:2NO2(g) ![]() N2O4(g) H < 0。监测反应获得如下数据:
N2O4(g) H < 0。监测反应获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法正确的是
A.0~20 s内,v(NO2) = 0.005 mol·L-1.s-1
B.59 s时,c(NO2)一定大于0.12 mol·L-1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K > 25/9
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4) < 0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
B.氢氧化钡与硫酸反应:OH-+H+===H2O
C.铜片插入硝酸银溶液中发生反应:Cu+Ag+===Cu2++Ag
D.氯化镁溶液与氢氧化钠溶液发生反应:Mg2++2OH-===Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下:
甲:K2SO4、BaCl2、NaCl
乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl
丁:K2SO4、Na2CO3、KCl
其中记录结果合理的是( )
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com