
| A. | PH4I可由PH3和HI化合而得 | |
| B. | PH4I在物质分类中属于正盐 | |
| C. | PH4I对热不稳定,受热时产生有色气体 | |
| D. | PH4I属于共价化合物 |
分析 根据题意可知化合物PH4I的结构和性质应与NH4Cl相似,根据NH4Cl的性质进行分析.
解答 解:化合物PH4I的结构和性质应与NH4Cl相似,则
A.由NH3和HCl反应生成NH4Cl,可知PH3和HI化合生成PH4I,故A正确.
B.NH4Cl在物质分类中属于正盐,所以PH4I在物质分类中属于正盐,故B正确;
C.由于HI不稳定,PH4I受热分解时,应生成PH3、H2和I2,产生有色气体,故C正确;
D.PH4I为离子化合物,故D错误;
故选D.
点评 本题考查信息迁移题目,题目难度不大,注意同族元素所形成的同一类型的化合物,其结构和性质往往相似这一点,根据NH4Cl的性质对比解答.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | X | Y | Z | W |  |
| A | Cu[ | CuSO4[来 | Cu(OH)2 | CuO | |
| B | Na | NaOH | NaCl | NaHCO3 | |
| C | 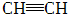 | CH2=CH2 | CH3CH3 | CH3CH2Cl | |
| D | Mg | MgO | MgSO4 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO3稳定,H2SO3不稳定 | B. | HClO4比H2SO3酸性强 | ||
| C. | HCl溶液是强酸,H2S溶液是弱酸 | D. | Fe与Cl2生成FeCl3,Fe与S生成FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离:H2CO3?H++HCO3- | |
| B. | 将金属钠放入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 碳酸钠水解:CO32-+2H2O?H2CO3+2OH- | |
| D. | 向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-=Al(OH )3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com