
| A. | 当b>2a时,发生的离子反应为:CO32-+2H+=H2O+CO2↑ | |
| B. | 当b<a时,发生的离子反应为:CO32-+H+=HCO3- | |
| C. | 当4a=3b时,发生的离子反应为:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 当a<b<2a时,反应生成的HCO3-与CO2的物质的量之比为(b-a):(2b-a) |
分析 当a≥b时二者反应生成碳酸氢钠:CO32-+H+=HCO3-,当b>2a时发生反应:CO32-+2H+=H2O+CO2↑,当a<b<2a时生成碳酸钠和碳酸氢钠的混合物,
A.当b>2a时,说明HCl过量,碳酸钠完全转化成二氧化碳气体;
B.当b<a时HCl不足,碳酸钠过量,反应生成碳酸氢钠;
C.当4a=3b时氯化氢部分过量,反应生成碳酸氢钠和二氧化碳,碳酸根离子与氢离子的物质的量之比为3:4;
D.当a<b<2a时,HCl部分过量,碳酸根离子先与氢离子反应生成碳酸氢根离子,剩余的氢离子与碳酸氢根离子反应生成二氧化碳,据此进行计算反应生成的HCO3-与CO2的物质的量之比.
解答 解:A.当b>2a时,HCl过量,反应生成氯化钠、二氧化碳气体和贺岁,发生反应的离子反应为:CO32-+2H+=H2O+CO2↑,故A正确;
B.当b<a时,碳酸钠过量,二者反应生成碳酸氢钠,反应的离子反应为:CO32-+H+=HCO3-,故B正确;
C.当4a=3b时,HCl部分过量,反应生成碳酸氢钠和二氧化碳,碳酸根离子与氢离子的物质的量之比为3:4,反应的离子方程式为:3CO32-+4H+=2HCO3-+CO2↑+H2O,故C正确;
D.当a<b<2a时,HCl部分过量,amolCO32-先与amol氢离子反应生成amol碳酸氢根离子,氢离子还剩余(b-a)mol,剩余的氢离子碳酸氢根离子反应生成二氧化碳,根据反应HCO3-+H+=H2O+CO2↑可知生成二氧化碳的物质的量为:(b-a)mol,剩余碳酸氢根离子的物质的量为:amol-(b-a)mol=(2a-b)mol,所以反应生成的HCO3-与CO2的物质的量之比为(2a-b)mol:(b-a)mol=(2a-b):(b-a),故D错误;
故选D.
点评 本题考查了离子方程式书写及计算,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,正确判断反应物过量情况对生成物的影响为解答关键,试题培养了学生的分析能力及化学计算能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:实验题
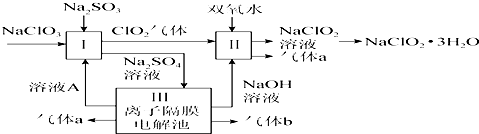
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
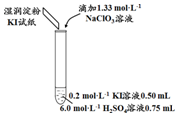 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |
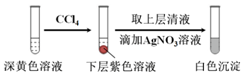
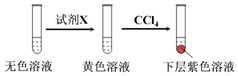
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )| A. | 该反应在高温时比低温更易自发进行 | |
| B. | 曲线I上A、C两点反应速率的关系是:vA<vC | |
| C. | T0时该反应的平衡常数为160 | |
| D. | 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则II是Fe2O3作催化剂的曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com