某化学活动小组利用如下装置对原电池进行研究,请回答下列问题(其中盐桥为含有KCl溶液的琼脂).
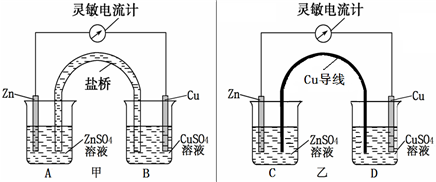
(1)、在甲图装置中,当电流计指针发生偏转时,盐桥中的离子移动方向为:K
+移向
B
B
烧杯,Cl
-移向
A
A
烧杯(填A或B),装置中电子转移的方向为:
由负极(Zn)沿导线移向正极(Cu)
由负极(Zn)沿导线移向正极(Cu)
.
(2)、如果将盐桥换成Cu导线(如乙图),该小组同学发现电流表指针仍然发生偏转,则C中可以构成
原电
原电
池,D中可以构成
电解/电镀
电解/电镀
池.
(3)、对乙图产生电流的原因猜想如下:
猜想一:ZnSO
4溶液水解显酸性,如该观点正确,则C中铜导线上的电极反应式为:
2H++2e-=H2↑
2H++2e-=H2↑
.
猜想二:ZnSO
4溶液酸性很弱,由于溶解了空气中的氧气而产生电流,如该观点正确,此时C中铜导线上的电极反应式为:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.
若猜想二正确,则可利用此原理设计电池为在偏远的海岛工作的灯塔供电,其装置以金属铝和石墨为电极,以海水为电解质溶液,试写出该电池工作时总反应的化学方程式
4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案