
为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是
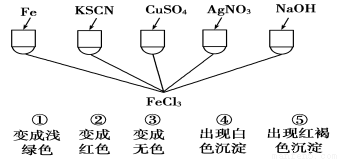
A.只有④ B.只有③ C.③和④均错 D.全部错误
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:填空题
某研究性学习小组探究在含有盐酸的Cu2+、Ca2+的混合溶液中滴加Na2CO3溶液时,发生反应的过程。【已知Ksp{CuOH2}小于Ksp(CuCO3)】
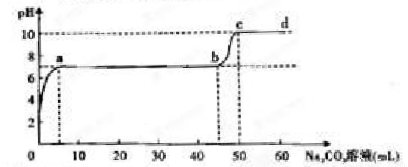
取适量样品溶液,插入pH传感器并逐滴滴入碳酸钠溶液。测得pH变化曲线如下图所示:
(1)为精确控制加入碳酸钠溶液的体积,可将碳酸钠溶液置于 (填仪器名称)中滴加。
(2)图中有两个pH增加较快的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对于a、b之间溶液的pH值变化缓慢的本质,该小组同学做出了如下推测,请补充推测2和3:
推测1:生成了Cu(OH)2沉淀,消耗了CO32-;
推测2: 。
推测3: 。
若推测1符合实际情况,则此情况下反应的离子方程式为 。
(4)请设计实验验证检验推测1(可不填满),不要写出详细的实验过程,试剂不受限制。
实验方法、步骤 | 实验现象和结论 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:填空题
(8分)SO2、NO是大气污染物。工业上吸收SO2 和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
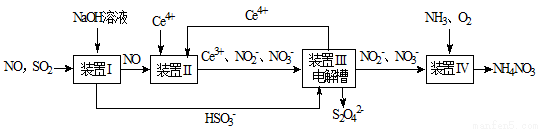
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为 ;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为 、 、过滤、洗涤等。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
A.NaAlH4中含有离子键和非极性共价键
B.每生成11. 2 L(标准状况下)H2,转移NA个电子
C.NaAlH4中氢元素为+1价,在反应中有50%的氢被还原
D.反应中氧化产物与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.Cl-一定存在,且c(Cl‑)≥0.4mol/L
B.至少存在5种离子
C.SO42-、NH4+一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在, K+可能存在
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列解释事实的化学方程式或离子方程式,不正确的是
A.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
B.向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2===2HClO+CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) CaCO3(s) + Na2SO4(aq)
CaCO3(s) + Na2SO4(aq)
D.工业上可用电解法制备Mg:MgCl2(熔融)  Mg + Cl2↑
Mg + Cl2↑
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42-
B.Mg2+、NH4+、Cl-、SO42-
C. Fe2+、H+、SO32-、ClO-
D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三年级第二次月考理综化学试卷(解析版) 题型:选择题
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55 nm的磁流体。下列说法中正确的是
A.所得的分散系属于悬浊液
B.该分散系能产生丁达尔效应且其中胶粒带正电荷
C.所得的分散系中分散质为Fe2O3
D.所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:实验题
(14分)工业上生产金属钛的方法很多。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
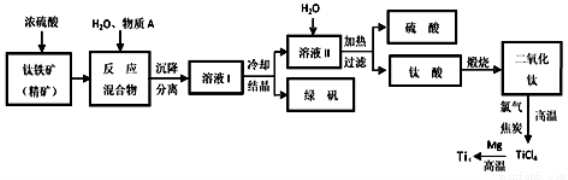
回答下列问题:
(1)钛铁矿和浓硫酸反应属于_________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是__________、___________。
(3)反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_____________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2 (s)+ 2Cl2 (g) +2C(s) =TiCl4(g) + 2CO(g)
ΔH1 = -72 kJ?mol-1 TiO2(s) + 2Cl2 (g) =TiCl4(g) + O2 (g)
ΔH2 =+38.8kJ?mol-1
C(s)+CO2(g)=2CO(g)? ΔH3 =+282.8kJ?mol-1
①反应C(s)+CO2(g)=2CO(g)在高温下能够自发进行
的原因是______________________。
②反应C(s)+O2(g)=CO2 (g)的ΔH=_______________。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO
作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
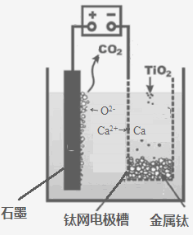
①写出阳极所发生反应的电极反应式:_______________________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com