
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示
意图如下,下列说法正确的是
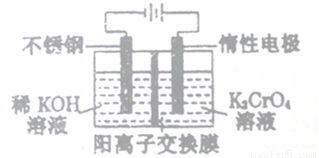
A. 在阳极室,通电后溶液逐渐由橙色变为黄色
B. 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g
C. 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA
D. 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:简答题
二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) ∆H1
CH3OCH3(g)+H2O(g) ∆H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g) ∆H2=-90.7 kJ·mol-1
CH3OH(g) ∆H2=-90.7 kJ·mol-1
③2CH3OH(g) CH3OCH3(g)+H2O(g) ∆H3
CH3OCH3(g)+H2O(g) ∆H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如下:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
则∆H1=__________kJ·mol-1、∆H3=__________kJ·mol-1
(2)反应①的化学平衡常数表达式为_____________。
制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______________。
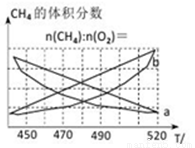
下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=_____________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
下列各项中表达正确的是
A. H、D、T表示同一种核素
B. F的结构示意图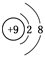
C. Na2O的电子式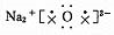
D. MgCl2的形成过程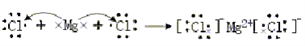
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是
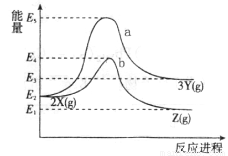
A. X→Y反应的活化能为E5
B. 加入催化剂曲线a变为曲线b
C. 升高温度增大吸热反应的活化能,从而使化学反应速率加快
D. 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
明代《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离( )
A. 汽油和氯化钠溶液 B. 39%的乙醇溶液
C. 氯化钠与单质溴的水溶液 D. 硝酸钾和氯化钠的混合物
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:选择题
下列叙述不正确的是
A. “蜡炬成灰泪始干”既包含物理变化又包含化学变化
B. Al2O3熔点高,可用于制作耐高温仪器
C. 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪经)
D. 利用CO合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
A、B、C、D、E 是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B、E同主族,下列推断不正确的是
A. A、B、E一定在不同周期
B. A、D可能在同一主族
C. C和D的单质可能化合形成离子化合物
D. C的最高价氧化物的水化物可能显碱性
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:填空题
偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:
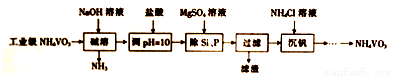
(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
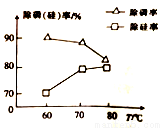
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:简答题
软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如右图所示。回答下列问题:
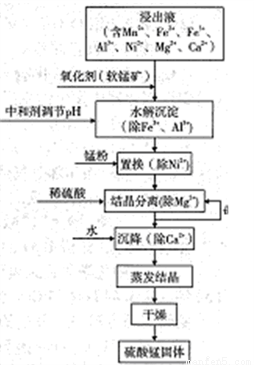
(1)软锰矿悬浊液吸收SO2的过程中,SO2体现了________性。
(2)“氧化剂”发生反应的离子方程式为____________。
(3)已知:Ksp[Al(OH) 3]=1.0×10-34;
Krp[Fe(OH) 3]=2.6×10-30;
Krp[Ni(OH) 2]=1.6×10-15;
Krp[Mn(OH) 2]=4.0×10-14;
“水解沉淀“中:
①“中和剂“可以是________(填标号)
A.Al2O3 B.H2SO4 C.MgO D.MnO2
②溶液的pH应不低于________(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)
③不采用“水解沉淀“除Ni2+的原因是___________。
(4)“置换”中发生反应的离子方程式为____________。
(5)“结品分离”中的部分物质的溶解度曲线如右图。
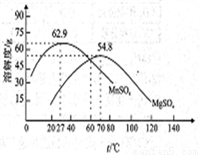
①加入稀硫酸的作用是(结合平衡移动原理解释)_____________。
②结晶与过滤过程中,体系温度均应维持在_______℃(填“27”、“60”或“70”)。
(6)高纯硫酸锰可用于水中溶解氧含量的测定,步骤如下:
步骤1:水中的氧气在碱性溶液中将MnSO4氧化为MnO(OH)2。
步骤2:在酸性条件下,加入KI将生成的MnO(OH)2再还原成Mn2+。
步骤3:用Na2S2O3标准溶液滴定步骤2中生成的I2(2S2O32-+I2=2I-+S4O62-)。
取某水样100mL,按上述测定步骤滴定,消耗a mol·L-1 NaS2O3标准溶液VmL,该水样溶解氧含量为
_________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com