
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2015-2016学年辽宁省高一下期中化学试卷(解析版) 题型:选择题
在5 L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g) N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
N2(g)+2CO2(g)。起始反应时NO和CO各为3 mol,保持密闭容器体积不变,10秒钟达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是
A.达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小
B.反应前5秒钟内,用CO表示的平均反应速率为0.04 mol·L-1·s-1
C.当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变
D.保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
有A、B、C、D、四种短周期元素,它们的原子序数依次增大,已知A和C原子最外层只有一个电子,C单质燃烧时的焰色为黄色,C单质在加热条件下与B的单质充分反应可以产生淡黄色固体化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素符号:A B C D
(2)写出反应的化学方程式:
①A单质与D单质反应: 。
②C单质与B单质在加热的条件下反应: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
不能作为元素周期表中元素排列顺序依据的是 ( )
A、元素原子的核电荷数 B、元素原子的核外电子数
C、元素原子的质子数 D、元素原子的中子数
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
为了提纯下列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 溴苯(溴) | 水 | 分液 |
B | 苯(甲苯) | CCl4 | 分液 |
C | 乙炔(硫化氢) | NaOH溶液 | 洗气 |
D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列物质中,在一定条件下,既能发生消去反应,又能发生水解反应的是( )
A.一氯甲烷 B.乙醇 C.溴乙烷 D.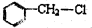
查看答案和解析>>
科目:高中化学 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:实验题
[化学~选修2:化学与技术]
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素。从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害。下图是用高炉烟尘制取硫酸锌的工业流程。
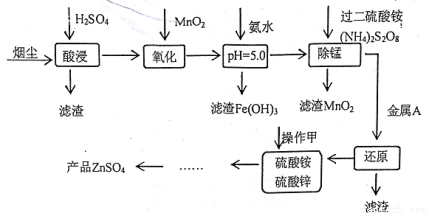
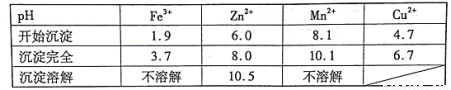
已知:①20℃时,0.1 mol.L-1的金属离子沉淀时的pH
②过二硫酸铵是一种强氧化剂。
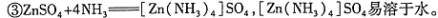
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?
(举出1种) 。
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是 。
(3)加入MnO2的目的是 。
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式 。
(5)写出还原过程发生的主要反应的离子方程式 。
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是 。
A锌粉 B氨水 C( NH4)2CO3 D NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A.若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B.若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C.若丙中含有第2周期ⅣA族的元素,则丙可能是甲烷的同系物
D.若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有—1价的元素
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:实验题
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
[实验Ⅰ]NaClO2晶体按如下图装置进行制取。
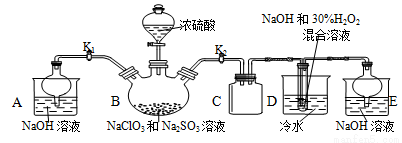
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,
高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C起的是 的作用。
(2)已知装置B中的产物有ClO2气体,装置D中生成NaClO2和一种助燃气体,其反应的化学方程式为 。
(3)从装置D反应后的溶液中获得NaClO2晶体的操作步骤为:①减压在55℃蒸发结晶;
② ;③用38℃~60℃热水洗涤;④低于 ℃干燥;得到成品。.
(4)反应结束后,打开K1,装置A起的作用是 ;如果撤去D中的冷水浴,可能导致
产品中混有的杂质是 。
[实验Ⅱ]样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则所称取的样品中NaClO2的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com