
关于下列各装置图的叙述中,正确的是
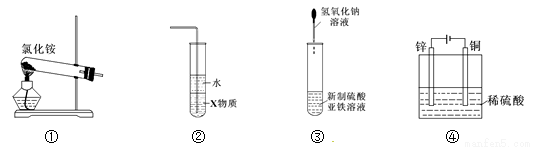
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并能防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是电解池,锌电极为正极,发生氧化反应
科目:高中化学 来源:2017届重庆市西北狼教育联盟高三12月月考化学试卷(解析版) 题型:选择题
常温时,下列叙述正确的是 ( )
A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低
B.用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低
C.pH均为11的NaOH和NH3·H2O溶液中,水的电离 程度不相同
程度不相同
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:填空题
分卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的__________区;溴原子基态的价电子排布式为____________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是__________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是__________(写出名称)。
| 氟 | 氯 | 溴 | 碘 |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为____________,写出一个ClO2-的等电子体__________。
(5)下图为碘晶体晶胞结构。有关说法中正确的是_________。
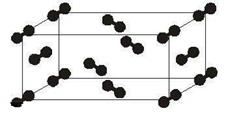
碘晶体晶胞
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子交替形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
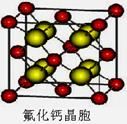
(6)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
下列说法不正确的是
A.向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性
B.一些有机溶剂(如乙醚、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热
C.在醋酸钠溶液中滴入酚酞试液,加热后红色加深,可证明盐类水解是吸热反应
D.可用溴水鉴别植物油和裂化汽油
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上模拟四化学试卷(解析版) 题型:填空题
在容积为1.0 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
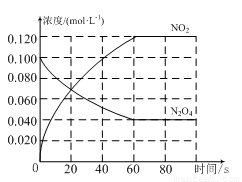
(1)反应的ΔH________0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为_______mol·L-1· s-1;反应的平衡常数K1为________。
s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________。
②列式计算温度T时 反应的平衡常数K2:________________________。
反应的平衡常数K2:________________________。
(3)温度T时反应达平衡后,将反应容器的容积缩小到一半,平衡向________(填“正反应”或“逆反 应”)方向移动,再次达
应”)方向移动,再次达 到平衡后,NO2的浓度 (填“增大”或“缩小”)。
到平衡后,NO2的浓度 (填“增大”或“缩小”)。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三11月阶段测化学卷(解析版) 题型:推断题
A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系 (反应物和产物中的H2O已略去):
(1)Y的电子式为 ,构成E单质的元素在周期表中的位置 。
(2)反应②的离子方程式为 。
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论: 。
(4)①写出检验N中阳离子常用的试剂名称 ,N也可用来净水,请写 出相关离子方程式 。
出相关离子方程式 。
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为 (不考虑生成CaSO4):
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三11月阶段测化学卷(解析版) 题型:选择题
某同学将光亮镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是 ( ):
选项 | 实验及现象 | 结论 |
A | 将润湿红色石蕊试纸靠近试管口,试纸变蓝 | 反应中有NH3产生 |
B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产 |
C | 收集气体的同时测得溶液的pH为8.0 | 生成Mg (OH)2 |
D | 向NH4Cl溶液中加锌,也有大量气泡产生 | 活泼金属可促进NH4+水解 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:实验题
甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
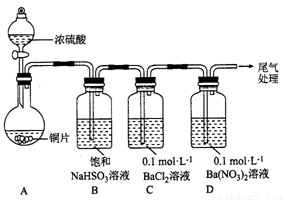
① A中反应的化学方程式是______________。
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现由色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价疏元素的物质性质继续进行探究。
序兮 | 实验搡作 | 实聆现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加人10mL 2 mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡,滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2 mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:________________。
② 由实验1、2、3对比,可以得到推论:________________。
③乙通过査阅资料发现.Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和 NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取____固体混合物,向其中加入10mL2 mol /LHNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;:滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:C1-的存在可以加快溶液中+4价硫元索的氧化;
ii.实验I和4对比,乙获得推论: ______________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加____________ (填字母序号)。
a.2 mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
B.2 mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
C.2 mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
D.2 mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
已知Zn2+的4s轨道和4p轨道可以形成sp3杂化轨道,那么[ZnCl4]2-的立体构型为
A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
答
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com