
| 相关实验 | 预期目的 | |
| A | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| B | 碘化钾溶液滴到土豆片上 | 证明淀粉遇碘变蓝 |
| C | 盐酸加入碳酸钠溶液中产生CO2 | 证明氯的非金属性比碳强 |
| D | 取规格相同的绿豆大的钠分别加入到水和乙醇中 | 证明乙醇羟基中氢原子不如水分子中氢原子活泼 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.温度不同,催化剂不同;
B.淀粉遇碘单质变蓝;
C.发生强酸制取弱酸的反应,但HCl为无氧酸;
D.Na与水反应剧烈,与乙醇反应较平稳.
解答 解:A.温度不同,催化剂不同,实验中有2个变量,则不能验证温度对化学反应速率的影响,故A错误;
B.淀粉遇碘单质变蓝,而KI中不含碘单质,不能验证结论,故B错误;
C.发生强酸制取弱酸的反应,但HCl为无氧酸,则不能利用HCl、碳酸的酸性比较非金属性,故C错误;
D.Na与水反应剧烈,与乙醇反应较平稳,则该实验可证明乙醇羟基中氢原子不如水分子中氢原子活泼,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率影响因素、酸性比较及物质性质、实验操作等,把握反应原理及实验基本技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题

 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 .
. .
. .
. 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,W与R以1:3的原子个数比形成的化合物的电子式
,W与R以1:3的原子个数比形成的化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在灼烧过程中使用的仪器有酒精灯、三脚架、泥三角、蒸发皿、玻璃棒 | |
| B. | 在上述氧化过程中发生的离子方程式为:2I-+H2O2═I2+2OH- | |
| C. | 在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 | |
| D. | 在提取碘单质时,用酒精作萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: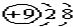 | |
| B. | 乙烷和丙烯互为同系物 | |
| C. | NaCl的电子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2属于同位素,化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
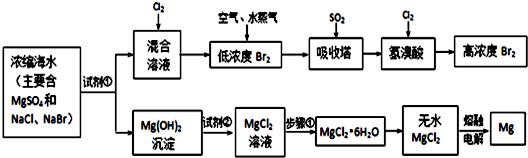
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 | |
| C. | 氢气的燃烧热为241.8 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)=2H2O(l) 的反应热为△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-) 相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl 的质量分数为25.38% | |
| D. | 20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com