
| A. | 1.5mol NaCl | B. | 0.5mol H2SO4 | C. | 0.6mol H2O2 | D. | 1mol HNO3 |
分析 1mol NaHCO3所含原子的物质的量为6mol,所以0.5mol NaHCO3所含原子的物质的量为:0.5mol×6=3mol,由此分析解答.
解答 解:A、1.5mol NaCl中原子的物质的量为:1.5mol×2=3mol,故A选;
B、0.5mol H2SO4中原子的物质的量为:0.5mol×7=3.5mol≠3mol,故B不选;
C、0.6mol H2O2中原子的物质的量为:0.6mol×4=2.4mol≠3mol,故C不选;
D、1mol HNO3中原子的物质的量为:1mol×5=5mol≠3mol,故D不选;
故选A.
点评 本题考查物质的量的相关计算,学生只要清楚微粒的构成,结合相关公式计算就可以迅速解题比较容易.


科目:高中化学 来源: 题型:解答题
 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

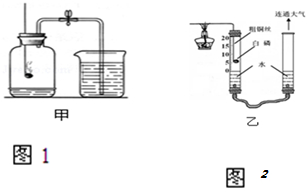
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
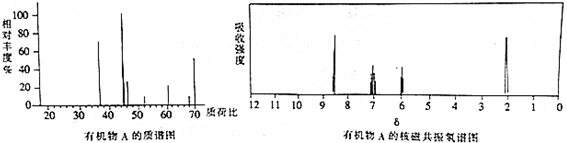
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
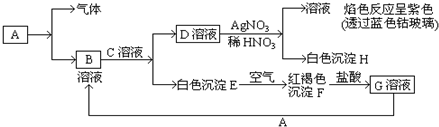
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-的水解方程式为:HCO${\;}_{3}^{-}$+H2O?H2CO3+OH- | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用铜做电极电解NaCl溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$4H++O2↑+2Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、NO3-、SO42- | B. | Ba2+、NH4+、Cl-、SO42- | ||
| C. | Na+、K+、ClO-、SO42- | D. | H+、Na+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L MgCl2溶液中含Cl-数为0.1NA | |
| B. | 1mol Na完全转化为Na2O2时,失去的电子数目为2NA | |
| C. | 含有NA个氢原子的氢气的体积约为11.2L | |
| D. | 1.8g NH4+中所含电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 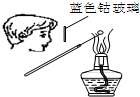 检验Na2CO3中的Na+ | B. | 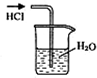 吸收HCl | ||
| C. | 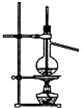 石油的蒸馏 | D. | 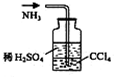 吸收NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com