
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应应:
A(g) B(g)+C(g)
△H =+85.1 kJ· mol-1
B(g)+C(g)
△H =+85.1 kJ· mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
|
时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
|
总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),
n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
|
反应时间t/h |
0 |
4 |
8 |
16 |
|
c(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1
(1)升高温度、降低压强
(2)α(A)=(  -1)×100%;94.1%;K=
-1)×100%;94.1%;K= =1.5;
=1.5;
(3)①0.1× ;0.1×(2-
;0.1×(2- );
);
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
【解析】
试题分析:(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
 =
= α(A)=(
α(A)=(
 -1)×100%;α(A)=(
-1)×100%;α(A)=( -1)×100%=94.1%
-1)×100%=94.1%
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,K= =1.5
=1.5
(3)①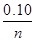 =
= n=0.1×
n=0.1× ;其中,n(A)=0.1-(0.1×
;其中,n(A)=0.1-(0.1× -0.1)=0.1×(2-
-0.1)=0.1×(2- )
)
②n(A)=0.1×(2- )=0.051 C(A)=0.051/1=0.051mol/L
)=0.051 C(A)=0.051/1=0.051mol/L
每间隔4小时,A的浓度为原来的一半。当反应12小时时,C(A)=0.026/2=0.013mol/L
考点:考察化学平衡知识,涉及平衡移动,转化率、平衡常数、平衡计算、反应速率、表格数据分析。


科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷带解析) 题型:计算题
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第6讲 化学反应速率和化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A (g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p /100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________________________________________________________________________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算a=__________________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省江门市高三调研测试理综化学试卷(解析版) 题型:填空题
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:H2(g)+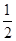 O2(g)=H2 O(g) △H=-241.8kJ·mol-1
O2(g)=H2 O(g) △H=-241.8kJ·mol-1
C(s)+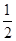 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)
△H
2NO(g)
△H 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在1.0 L密闭容器内经过5s反应达到平衡,测得NO为8.0×10-4 mol。
①5s内该反应的平均速率ν(NO) = (保留2位有效数字);在1300oC 时,该反应的平
衡常数表达式K= 。
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。右图表示在其他条件不变时,反应2NO(g)+2CO(g)
 2CO2(g)+N2(g) 中,NO的浓度
2CO2(g)+N2(g) 中,NO的浓度
c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷解析版) 题型:计算题
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应应:
A(g) B(g)+C(g) △H=+85.1kJ·mol-1
B(g)+C(g) △H=+85.1kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
|
时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
|
总压强p/100kPa |
4.91 |
5.58 |
6.32 |
7.31 |
8.54 |
9.50 |
9.52 |
9.53 |
9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为 ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
|
反应时间t/h |
0 |
4 |
8 |
16 |
|
C(A)/(mol·L-1) |
0.10 |
a |
0.026 |
0.0065 |
分析该反应中反应反应物的浓度c(A)变化与时间间隔(△t)的规律,得出的结论是 ,
由此规律推出反应在12h时反应物的浓度c(A)为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com