
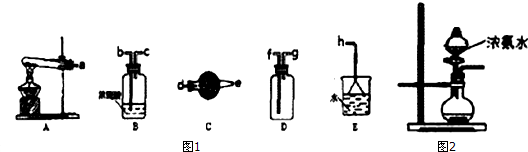
分析 在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙,
(1)由图可知,利用图1进行实验室制取、收集干燥的NH3,A装置发生固体加热反应制备氨气,经C干燥后在D中收集,且连接E装置防止倒吸;
(2)用图2所示装置也可以制取NH3,分液漏斗中为浓氨水,则烧瓶中固体为CaO或碱;
(3)二氧化碳微溶于水,应先通入氨气;
(4)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以根据胶体的性质确定实验方案.
解答 解:(1)由图可知,利用图1进行实验室制取、收集干燥的NH3,A装置发生固体加热反应制备氨气,经C干燥后在D中收集,干燥时气体大口进小口出,收集氨气为向下排空气法,且连接E装置防止倒吸,则仪器装置的接口连接顺序是a接d,e接g,f接h,故答案为:d;e;g;f;
(2)用图2所示装置也可以制取NH3,分液漏斗中为浓氨水,则烧瓶中固体为CaO或碱,该装置是固液不加热型,且氨水极易挥发,温度越高,挥发越快;碱石灰、氢氧化钠、生石灰的溶解过程放出大量的热,相当于加热,则ABE均符合,故答案为:ABE;
(3)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵CaCl2+CO2+2NH3+H2O═CaCO3(胶体)+2NH4Cl,
故答案为:NH3;CaCl2+CO2+2NH3+H2O═CaCO3(胶体)+2NH4Cl;
(4)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以具有胶体的性质,运用胶体的丁达尔效应判断;取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,
故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高频考点,注意根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,SO2的转化率:A>B | |
| B. | 起始时的反应速率:A=B,反应完成时的平均速率:A>B | |
| C. | 达到平衡后再充入等量氩气,A、B中平衡均不发生移动 | |
| D. | 达到平衡后再向A中充入等量的原反应气体,再次平衡时SO2的质量分数与前次相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物的减小或任何一种生成物的增加 | |
| B. | 化学反应速率0.8mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?2XY2 | B. | 2X2+Y2?2X2Y | C. | X2+3Y2?2XY3 | D. | 3X2+Y2?2X3Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 48.2% | B. | 33.6% | C. | 29.4% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上Cu+2H+═Cu2++H2↑ | |
| B. | 氧化铜与硫酸混合Cu2++SO42--═CuSO4 | |
| C. | 硝酸滴在石灰石上CO32-+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸钠溶液与氯化钡溶液混合Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com