
分析 (1)依据氧化还原反应规律:S8与氢氧化钠反应生成一种产物亚硫酸钾,硫元素化合价升高,则必有化合价降低产物,应为硫化钠,结合氧化还原反应得失电子守恒书写方程式;
(2)依据方程式:2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,计算解答.
解答 解:(1)依据题意可知单质硫与氢氧化钠发生歧化反应生成硫化钠和亚硫酸钠和水,方程式:3S8+48NaOH=16Na2S+8Na2SO3,离子方程式:3S8+48OH-=24H2O+16S2-+8SO32-,故答案为:3S8+48OH-=24H2O+16S2-+8SO32-;
(2)标准状况下将2.24L H2S与2.24L O2 物质的量都是0.1mol,硫化氢与氧气反应先生成硫单质,硫单质再与氧气反应生成二氧化硫,则:
2H2S+O2(少量)$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O,
2 1 2
0.1 0.05 0.1
S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
1 1 1
0.05 0.05 0.05
所以生成硫的物质的量为0.1mol-0.05mol=0.05mol;
反应后气体为二氧化硫,相对分子质量为64,反应前气体为硫化氢与氧气11混合,平均相对分子质量为$\frac{34+32}{2}$=33
依据相同条件下气体密度之比等于摩尔质量质量等于相对分子质量之比,则待温度恢复到原温度时,容器中气体密度是原来的$\frac{64}{33}$倍;
故答案为:0.05mol;$\frac{64}{33}$.
点评 本题考查了离子方程式书写,有关方程式的计算,明确硫及其化合物性质,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SiO2通常用于通讯行业 | B. | 硅胶常用于食品袋中的干燥剂 | ||
| C. | SO2可用于食品行业的漂白剂 | D. | 氧化铝可用于制造坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HCl加成 | |
| B. | CH3CH2CH2Cl在碱性溶液中水解 | |
| C. | CH2═CH-CH═CH2与H2按物质的量之比为1﹕1进行反应 | |
| D. | 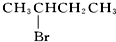 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为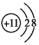 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com