
(12分)请填入相应化学试剂以除去括号中的杂质,并写出相应的化学反应方程式。(加入的试剂为适量,反应条件自行选择)
(1)Na2SO4溶液(MgSO4)试剂:______________化学方程式:_______________________
(2)Cu(CuO)试剂:______________化学方程式:________________________________
(3)CO(CO2)试剂:______________化学方程式:________________________________
科目:高中化学 来源:2015-2016学年山西省高一上第一次月考化学试卷(解析版) 题型:实验题
(14分)已知某“84消毒液”瓶体部分标签如右所示,该“84消毒液”通常稀释到100倍(体积之比)后使用。请回答下列问题:

I(1)该“84消毒液”的物质的量浓度约为__________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)为__________ mol·L-1。
II某同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。实验步骤如下:
① 将烧杯中的溶液转移至容量瓶中;
② 计算并称量所需的NaClO固体;
③ 向容量瓶中加蒸馏水至液面与刻度线相平;
④ 将NaClO加入100mL 烧杯中,并加适量水溶解;
⑤ 洗涤烧杯和玻璃棒2次,洗涤后溶液转移至容量瓶中;
⑥ 振荡摇匀;
⑦ 颠倒摇匀。
(1)完成上述实验,下图所示的仪器中,还需要添加的玻璃仪器是 。
(2)步骤②中计算所需要NaClO的质量为 g;
(3)实验的先后顺序应为 (填写序号);
(4)在步骤①中,为防止溶液溅出,应采取的措施是 ;
(5)在进行步骤③的实验操作时应注意的问题是 ;
(6)配制溶液时,下列实验操作会使配制溶液浓度偏高的是 。
A.容量瓶内有水,未经过干燥处理
B.进行步骤③操作时,俯视刻度线
C.缺少步骤⑤
D.定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线
E.缺少步骤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
已知C(s,石墨)=C(s,金刚石)ΔH >0,下列判断正确的是
A、此反应为放热反应
B、断裂1 mol石墨的化学键需要吸收的能量小于生成1 mol金刚石化学键所放出的能量
C、石墨比金刚石稳定
D、此变化为物理变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆巴蜀中学高一上10月月考化学试卷(解析版) 题型:选择题
同温同压下,xg甲气体和yg乙气体占有相同的体积,根据阿伏加德罗定律判断下列叙述错误的是
A.x:y等于甲与乙的相对分子质量之比
B.x:y等于甲与乙的分子个数之比
C.x:y等于同温同压下甲与乙的密度之比
D.y:x等于同温同体积下,等质量的甲与乙的压强之比
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:填空题
(16分)(1)取 300mL 0.2mol/L 的 KI 溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2 和 KIO3,则消耗 KMnO4 的物质的量的是 mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是用离子方程式解释 .
(3)在 100mLFeBr2 溶液中通入标况下2.24LCl2, 溶液溶液中有 1/4的 Br-被氧化成单质 Br2,则原 FeBr2 溶液中 FeBr2 的物质的量浓度为 。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式____ 。向反应后的溶液中通入过量CO2,反应的离子方程式为 _______________________________。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式 ,反应中生成0.2mol HNO3,转移的电子数目为 。②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上期中理综化学试卷(解析版) 题型:填空题
【化学选修2: 化学与技术】(15分)
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹。
(1)新型陶瓷Si3N4的熔点高、硬度大、化学性质稳定。工业上可以采用化学气相沉积法,在H2的保护下,使SiCl4与N2反应生成Si3N4沉积在石墨表面,写出该反应的化学方程式 。
(2)一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
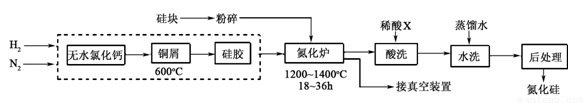
①净化N2和H2时,铜屑的作用是: ;硅胶的作用是 。
②在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度 ;体系中要通入适量的氢气是为了 。
③X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(3)工业上可以通过如下图所示的流程制取纯硅:

①整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应,写出该反应的化学方程式 。
②假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第一次月考化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)由B3O3制备BF3、BN的化学方程式依次是_____________、_____________;
(2)基态B原子的电子排布式为____________;B和N相比,电负性较大的是___________,BN中B元素的化合价为______________;
(3)在BF3分子中,F—B—F的键角是____________,B原子的杂化轨道类型为____________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为_____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层层内B原子与N原子之间的化学键为___________,层间作用力为___________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有_________________个氮原子、______________个硼原子,立方氮化硼的密度是_________________g.cm-3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
对于反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
4NO(g) + 6H2O(g), 下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)= 0.2mol·L-1·s-1 B.v(O2 )= 0.24 mol·L-1·s-1
C.v(H2O)= 0.25 mol·L-1·s-1 D.v(NO) = 0.15 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com