
| A、0.1 mol 铁与0.1 mol 氯气充分反应转移电子数为0.3NA |
| B、8.0gCu2S和CuO的混合物中含有的铜离子数为0.2NA |
| C、1 mol 乙醇和 1 mol乙烷分子中含有的非极性键数目都是NA |
| D、标准状况下22.4L氢气和8g氦气均含有NA个分子 |
| 8g |
| 160g/mol |
| 8g |
| 80g/mol |


科目:高中化学 来源: 题型:
| A、36g镁在足量的氮气中完全燃烧共转移的电子数为3NA |
| B、常温下,1L 0.1mol/L的NH4NO3溶液中含氮原子数为0.2NA |
| C、标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA |
| D、1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲烷中的氢原子被氯原子完全取代,需要氯气的分子数为2NA |
| B、7.8gNa2O2与CO2完全反应转移的电子数为0.1NA |
| C、100mL2.0mol/L的NaOH溶液与Al反应转移了0.3NA电子,生成的H2必为3.36L |
| D、在pH═13的溶液中,OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L水中含分子数为NA |
| B、23g金属Na与1L0.1mol/L的盐酸溶液反应,生成0.1NA个H2 |
| C、标准状况下,2.24L18O2中所含中子的数目为NA |
| D、14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Ca2+、NO3-、Cl- |
| B、Ba2+、AlO2-、SO42-、Mg2+ |
| C、Na+、Al3+、SO42-、NO3- |
| D、K+、Na+、NO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| c(NH3?H2O) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |

| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、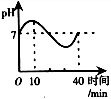 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com