
| A、加热 |
| B、加FeCl2作催化剂 |
| C、加水稀释 |
| D、加MnO2作催化剂 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu+2H2SO4(浓)
| ||||
B、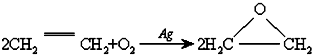 | ||||
| C、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ||||
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用18.4mol?L-1的硫酸 |
| B、升高溶液的温度 |
| C、向溶液中加入少量铜粉 |
| D、把锌块(片)换成锌粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |

| 时 间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com