
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒.我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: 
下列有关该反应的叙述中正确的是( )
A.该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl
B.该反应是应是复分解反应
C.反应中Cl2既是氧化剂,又是还原剂
D.NaClO2和ClO2中Cl元素的化合价相同
【答案】A
【解析】解:A.由三种小球表示的原子及微观过程可知,反应物为氯气和NaClO2 , 生成物为ClO2和NaCl,则反应为Cl2+2NaClO2═2ClO2+2NaCl,故A正确;
B.由不同的小球代表的原子可知,反应物为氯气和NaClO2 , 氯气为单质,则该反应一定不是复分解反应,故B错误;
C.Cl2+2NaClO2═2ClO2+2NaCl,反应中氯气中 的氯元素化合价0价变化为﹣1价,NaClO2中氯元素化合价+3价升高到+4价,所以氯气做氧化剂,故C错误;
D.根据化合价规则,NaClO2和ClO2中Cl的化合价分别是+3价和+4价,化合价不一样,故D错误;
故选A.
A.由不同小球代表的原子及反应的微观过程来分析,书写反应方程式;
B.复分解反应是化合物与化合物反应生成化合物与化合物的反应;
C.依据化学方程式中氯元素化合价的变化判断,氯气中 氯元素化合价0价变化为﹣1价;
D.根据化合物中元素化合价代数和为0计算来确定元素的化合价.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2不能全部转化达为SO3
2SO3反应中,SO2不能全部转化达为SO3
D. 实验室用碳酸钙和盐酸反应制取CO2,若将块状碳酸钙粉碎,会加快反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.常温常压下,18 g H2O分子中含有的原子总数为3NA
B.标准状况下,11.2 L乙醇中含有分子的数目为0.5NA
C.常温常压下,2.24 LCO2中含有的C原子数目为0.1NA
D.标准状况下,分子数为NA的氧气和氮气的混合气体所占的体积为44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是( )
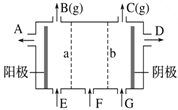
A. 阴极反应式为4OH--4e-===2H2O+O2↑
B. 从A口出来的是NaOH溶液
C. b是阳离子交换膜,允许Na+通过,B口出来的是O2
D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.常温常压下,18 g H2O分子中含有的原子总数为3NA
B.标准状况下,11.2 L乙醇中含有分子的数目为0.5NA
C.常温常压下,2.24 LCO2中含有的C原子数目为0.1NA
D.标准状况下,分子数为NA的氧气和氮气的混合气体所占的体积为44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在xR2++yH++O2===mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是
A. m=4;R2+是还原剂 B. m=y;R3+是氧化产物
C. m=2;R2+是氧化剂 D. m=y;R3+是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com