



 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������Ϊ8��11 | B�����Ӹ���֮��Ϊ11: 12 |
| C�����ʵ���֮��Ϊ8��11 | D��ԭ�Ӹ���֮��Ϊ11: 12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��1 L0.1 mol/L Na2CO3��Һ�� ��HCO��3����Ϊ0��1 NA ��HCO��3����Ϊ0��1 NA |
| B��22.4L������4g����������NA������ |
| C����2NA���ۼ���CnH2n+2���ӵ����ʵ���Ϊ2/(3n+l) mol |
| D����״���£�2.24LCl2��ϡNaOH��Һ��Ӧ��ת�Ƶĵ�������Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ȡ7.7gCuSO4������500mLˮ |
| B����ȡ12.5g�������480mL��Һ |
| C����ȡ7.7g CuSO4�����480mL��Һ |
| D����ȡ12.5g�������500mL��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
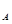 ��ʾ�����ӵ�������ֵ������������ȷ����( )
��ʾ�����ӵ�������ֵ������������ȷ����( ) A��1.2 g  �����������Ӻ������ӵ�����Ϊ0.03 N �����������Ӻ������ӵ�����Ϊ0.03 N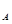 |
B��100 mL 18.4  ����������ͭ��Ӧ,���� ����������ͭ��Ӧ,���� �ķ�����Ϊ0.92 N �ķ�����Ϊ0.92 N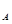 |
C��1 L 1  �� �� ��Һ����������С��3N ��Һ����������С��3N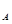 |
D��������,42.0 g��ϩ�ͱ�ϩ�Ļ�������к��е�̼ԭ����Ϊ3N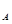 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | Na+ | AL3+ | CL- | X |
| ���� | 3a | 2a | a | b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
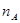 ��ʾ�����ӵ�������ֵ������������ȷ����
��ʾ�����ӵ�������ֵ������������ȷ����A�� �к��еĵ�����Ϊ �к��еĵ�����Ϊ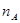 |
B�� �к��е�ԭ����Ϊ �к��е�ԭ����Ϊ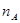 |
C�� ����Һ�е������ ����Һ�е������ ��Ϊ ��Ϊ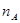 |
D����״���£� ���к��еķ�����Ϊ ���к��еķ�����Ϊ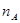 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com