
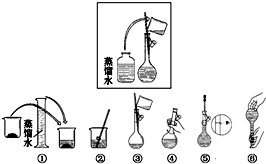
 某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.
某同学帮助水质检测站配制480mL0.5mol•L-1NaOH溶液.分析 (1)配制480mL 0.5mol•L-1 NaOH溶液,应选择500mL容量瓶,结合m=cVM计算;
(2)选取容量瓶的规格应该等于或稍大于配制溶液的体积;容量瓶上标有温度、刻度线以及规格三项内容;
(3)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)配制一定物质的量浓度的溶液的操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,如图所示的操作为移液洗涤后向容量瓶内加水,应在加水振荡与定容之间;
(5)具体分析操作对溶质的物质的量及溶液体积的影响,根据c=$\frac{n}{v}$判断误差.
解答 解:(1)配制480mL 0.5mol•L-1 NaOH溶液,NaOH的质量为0.5L×0.5mol/L×40g/mol=10.0g,
故答案为:10.0;
(2)选取容量瓶的规格应该等于或稍大于配制溶液的体积,实验室没有480mL容量瓶,所以应该选500mL容量瓶,容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量容器,容量瓶上标有容量、刻度线,故③⑥正确,
容量瓶只能在常温下使用,不能用来盛装过冷或过热的液体,不能用来稀释溶液或作为反应容器,则①正确.
与②浓度、④压强、⑤酸式或碱式无关.
容量瓶上需标有六项中的①③⑥.
故答案为:500;①③⑥;
(3)操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般用天平称量,在烧杯中溶解,并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,还需要的玻璃仪器是胶头滴管,
故答案为:胶头滴管;
(4)配制500mL 0.5mol•L-1NaOH溶液的操作步骤:首先计算出需要的药品的质量,然后用托盘天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1~2cm时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.图所示的步骤是移液洗涤后向容量瓶内加水,应在加水振荡与定容之间,故应在④和⑤之间,
故答案为:A;
(5)①转移时没有洗涤烧杯和玻璃,会导致溶质的损失,则浓度偏低,
故答案为:偏小;
②配制前容量瓶用水洗涤后未进行干燥处理,对溶质的物质的量、最终溶液的体积都无影响,所以不影响溶液浓度,
故答案为:无影响.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,题目难度不大,试题培养了学生的分析能力及化学检验能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
在 10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是
10—9m~10—7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是
A.纳米铜是一种新型化合物 B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同 D.纳米铜无需密封保存
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )
某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )| A. | 用如图乙量取一定体积的待测白醋放入锥形瓶中 | |
| B. | 观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致食用白醋中醋酸的含量偏小 | |
| C. | 碱式滴定管尖嘴部分有气泡,滴定后消失,则结果会导致食用白醋中醋酸的含量偏大 | |
| D. | 滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
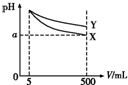 将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )
将5 mL pH=11的X、Y两种碱分别稀释至500 mL,其pH与溶液体积(V)的关系如图,下列说法正确的是( )| A. | 若X、Y都是弱碱,则a的值一定大于9 | |
| B. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积V(X)>V(Y) | |
| C. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| D. | 若X、Y是一元碱,则等物质的量浓度的Y的硝酸盐溶液的pH比X的硝酸盐溶液大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 新制氯水可使蓝以石蕊试纸先变红,后褪色 | |
| B. | 新制氯水中只含有Cl2和H2O分子 | |
| C. | 氯水放置数天后,酸性增强 | |
| D. | 光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤⑥ | C. | 全部 | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com