
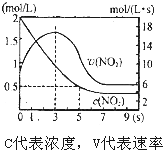
| A. | 5s 时NO2的转化率为75% | |
| B. | 0-3s 时v(NO2 )增大是由于体系温度升高 | |
| C. | 3s 时化学反应处于平衡状态 | |
| D. | 9s 时再充入N2O4,平衡后平衡常数K 较第一次平衡时大 |
分析 A、分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%;
B、依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大;
C、3s时二氧化氮反应速率最大,但随时间变化,速率减小,在7s后二氧化氮浓度不变是平衡状态,此时不能说明反应达到平衡状态;
D、9s时反应达到平衡状态,加入N2O4,平衡逆向进行,反应热量降低,平衡向放热分析进行,平衡常数增大.
解答 解:A、分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%=$\frac{1.5mol/L}{2mol/L}$×100%=75%,故A正确;
B、依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,随反应进行二氧化氮浓度减小,反应为达到平衡,0-3s时v(NO2)增大是由于体系温度升高,故B正确;
C、3s时二氧化氮反应速率最大,但随时间变化,速率减小,在7s后二氧化氮浓度不变是平衡状态,3s此时不是平衡状态,故C错误;
D、9s时反应达到平衡状态,加入N2O4,平衡逆向进行,反应热量降低,平衡向放热分析进行,平衡常数增大,9s时再充入N2O4,平衡后K较第一次平衡时大,故D正确;
故选C.
点评 本题考查了图象分析判断,反应速率、转化率概念计算分析,平衡状态判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
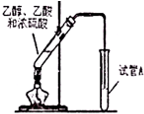 “酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯.
“酒是陈的香”,其原因之一是酒在储存过程中生成了具有香味的乙酸乙酯,在实验室我们也可以用如图所示的装罝制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验目的或结论 |
| A | 取1ml20%蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,取少量溶液,加入少量新制的Cu(OH)2,加热,没有砖红色沉淀生成 | 蔗糖没有水解 |
| B | SO2通入Ba(NO3)2溶液,生成白色沉淀 | 生成白色Ba(SO3)2沉淀 |
| C | 铜放入稀硫酸中无明显现象,再加入硝酸钠固体,有明显的气泡冒出,溶液变蓝,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向盛有3mL约5%的H2O2溶液中加入1~2滴1mol/LFeCl3溶液;有大量气泡出现,能使带火星的火柴梗复燃 | FeCl3可以催化H2O2分解的反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn( S )+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| B. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| C. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 | |
| D. | 当溶液中固体质量不再变化时达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M原子所含质子数一定大于R原子所含质子数 | |
| B. | M、R两种元素结合形成的化合物中不可能含有共价键 | |
| C. | M2-与R+的电子层结构不可能相同 | |
| D. | M一定存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化石燃料是可再生能源,燃烧时将化学能转变为热能 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液是强酸溶液,该溶液中一定含有分子 | |
| B. | 若溶液显碱性,该溶液一定是碱溶液 | |
| C. | 无论是强酸溶液还是强碱溶液,加入金属Al一定会放出H2 | |
| D. | 向该溶液中加入酸化的BaCl2溶液,可验证是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
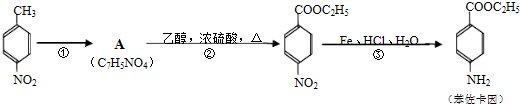
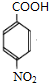 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$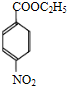 +H2O;
+H2O;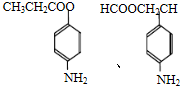 ,则剩余三种同分异构体的结构简式为:
,则剩余三种同分异构体的结构简式为: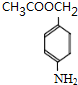 、
、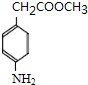 、
、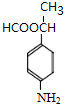 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com