
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是绿色化学的基本要求.
①在有机实验中,用溴的四氯化碳溶液代替溴的水溶液;
②用稀硝酸代替浓硝酸溶解、回收含银镜试管里的银;
③用水浴加热代替直接用酒精灯加热;
④接触法制硫酸中采用“热交换器”,利用余热预热冷原料气和烧水;
⑤工业合成氨中分离产物得到氢气和氮气再循环使用;
⑥电解法冶炼钠和镁,选择电解氯化钠和氯化镁,不电解对应的金属氧化物.
上述主要不是从绿色化学角度考虑的是
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列四种溶液中①pH=0的盐酸,②0.1 mol·L-1的盐酸,③0.01 mol·L-1NaOH溶液,④pH=11的NaOH溶液,
由水电离生成的氢离子浓度之比(①∶②∶③∶④)是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下面是关于中和滴定的实验叙述:取25 mL未知浓度的HCl溶液。在横线标明的操作中,有错误的是
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。
b.并将该瓶用待测液润洗过。c.加入几滴酚酞作指示剂。
d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
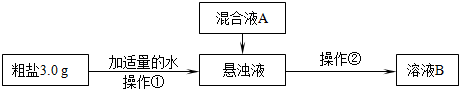
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 4.96×10-9 | 4.96×10-9 | 2.34×10-9 | 5.61×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com