

| ��c |
| ��t |
| ����ƽ��Ũ��ϵ������֮�� |
| ��Ӧ��ƽ��Ũ��ϵ������֮�� |
| ��c |
| ��t |
| ||
| tB |
| nB |
| 2tB |
| nB |
| 2tB |
| 1 |
| 2 |
| 1 |
| 2 |
 CH3OH��l��+H2O��l����H=-130.9 kJ?mol-1���ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9 kJ?mol-1��
CH3OH��l��+H2O��l����H=-130.9 kJ?mol-1���ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��l����H=-130.9 kJ?mol-1��| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
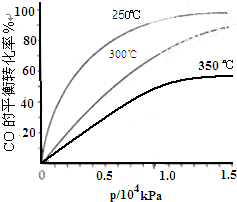 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��ɽ��ʡ����ʦ����ѧ����2006~2007ѧ��ȵڶ�ѧ����ĩ���ԡ���һ��ѧ���� ���ͣ�022
| |||||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ������ʮ���ظ߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
ú��Һ���ǰѹ���ú̿ͨ����ѧ�ӹ����̣�ʹ��ת����ΪҺ��ȼ�ϡ�����ԭ�ϺͲ�Ʒ���Ƚ��ྻú���������кϳ�CH3OH ������Ҫ���о�����֮һ����2L���ܱ������У���CO2��H2�ϳɼ״�CO2��g��+3H2��g�� CH3OH��g��+H2O��g�����������������������£�̽���¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T2��T1������300�棩��
CH3OH��g��+H2O��g�����������������������£�̽���¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T2��T1������300�棩��

��ͨ��������ͼ�����Եó��Է�ӦCO2��g��+3H2��g�� CH3OH��g��+H2O��g����˵����ȷ���ǣ���
CH3OH��g��+H2O��g����˵����ȷ���ǣ���
��ţ� ��
A���÷�ӦΪ���ȷ�Ӧ
B.T1ʱ�ķ�Ӧ���ʴ���T2ʱ�ķ�Ӧ����
C.�÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ�
D.����A��ķ�Ӧ��ϵ��T1�䵽T2����ƽ��ʱn(H2)/n(CH3OH)����
������������˵��������Ӧ�Ѵﵽƽ��״̬���� ������ţ�
a����ϵѹǿ���ֲ��� b��v(H2)��3v(CO2)
c��CH3OH��H2���ʵ���֮��Ϊ1:3 d��ÿ����1 mol CO2��ͬʱ����3molH2
e.�ܱ������л��������ܶȲ��� f.�ܱ�������CH3OH�������������
����T1�¶�ʱ����2molCO2��6molH2������ܱ������У���ַ�Ӧ��ƽ��ʱ����CO2��ת����Ϊ60%���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ���÷�Ӧ��ƽ�ⳣ��Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com