
【题目】细胞鲜重中,质量分数最高的化合物和元素分别是
A. 蛋白质、C B. 蛋白质、0 C. 水、C D. 水、0
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)![]() 2HI(g) △H= - 9.48kJ/mol
2HI(g) △H= - 9.48kJ/mol
(ii) I2(s)+H2(g)![]() 2HI(g) △H= + 26.48kJ/mol,下列判断正确的是 ( )
2HI(g) △H= + 26.48kJ/mol,下列判断正确的是 ( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差l7.00kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(i)拆开1molI-I键与1molH-H键需要的总能量小于拆开2molH-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合重重铬酸钠(Na2Cr2O7.2H2O),[已知M(Na2Cr2O7.2H2O)=298g/mol]俗称红矾钠,在工业方面有广泛用途。我国目前主要是以铬铁矿(主要成份为FeO.Cr2O3,还含有A1203、MgO、Si02等杂质)为主要原料生产,其主要工艺流程如图:
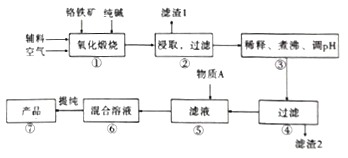
已知信息:
Ⅰ.“①”中涉及的主要反应是:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
Ⅱ.部分阳离子以氢氧化物形式完全沉淀时溶液的PH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液PH | 4.7 | 3.7 | 11.2 | 5.6 |
(1).杂质A12O3、SiO2与纯碱反应转变为可溶性盐,写出A12O3纯碱反应的化学方程式为:______________,滤渣1的主要成分为__________________。
(2).“③”中通过调节PH除去杂质,调节PH至___________。
(3).“⑤”中向滤液中加入物质A,得到Na2Cr2O3和Na2SO4的混合溶液,物质A为__________,简述原因:______________________________。(用离子方程式及文字加以说明)
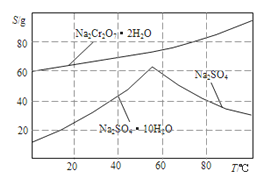
(4).如图是Na2Cr2O3.2H2O和Na2SO4的溶解度曲线。提纯的实验操作:将Na2Cr2O3和Na2SO4的混合溶液______________________,得到Na2SO4固体和较纯净的Na2Cr2O3溶液。
(5).实验室测定所得产品中红矾钠的纯度,称取产品3.2g,配成250mol溶液,取出25.00mL于锥形瓶中,加入10mL2mol/LH2SO4和足量碘化钾,放于暗处5min,写出离子方程式:________________。然后加水100mL,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定I2+2S2O32-=2I-+S4O62-若达到滴定终点时,共用去Na2S2O3标准溶液60mL,所得产品的纯度是_________(结果保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g) ![]() 3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生重大影响。
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_____________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅晶体的描述错误的是
A.分子式为SiO2 B.熔化时共价键断裂
C.属于酸性氧化物 D.1mol SiO2中含有4 mol Si—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取氯酸钾的主要步骤为:
I.将C12通入石灰浆,充分反应后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
步骤I存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
(1)①标出反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 中电子转移的方向和数目
② 滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]___________l:5(填“>”、“<”或“=”),理由是___________ 。(请用有关反应和必要的文字进行说明)
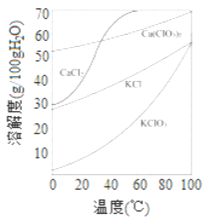
(2)上图是有关物质的溶解度曲线. 步骤II中,若溶液中KClO3的含量为100g·L-1,从该溶液中尽可能多地析出KClO3 固体的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g。实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
A.石灰水,W1=W2
B.乙醇溶液,W1=W2
C.NaHSO4,W1<W2
D.CO,W1>W2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 常温常压下,1.06 g Na2CO3溶于水含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4 L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com