
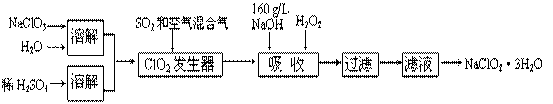
| A��Na2O2 | B��Na2S | C��FeCl2 | D��KMnO4 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͭ�Ͻ� | B���մ� | C������ϩ | D���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ���������ɽ��м״��ϳɡ�
2S�ɲ��ô���Ǵ�ת����������CH4ת����CO���õ�CO��CO2��H2�Ļ�����壬������ĺϳɼ״�ԭ���������ɽ��м״��ϳɡ�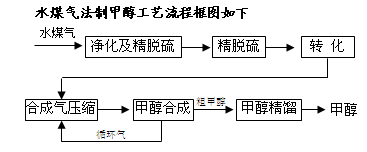
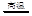 CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
CO��g��+H2��g�����˷�Ӧ�����ȷ�Ӧ���ٴ˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ �� ��ʩ�� ��(����ĸ����)
��ʩ�� ��(����ĸ����)| A������C��s�� | B������H2O��g�� | C�������¶� | D������ѹǿ |
 CH3OH(g)����H ����90.8kJ��mol��1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OH(g)����H ����90.8kJ��mol��1��T4���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������м���CO��H2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol��L��1�� | 0.2 | 0.1 | 0.4[ |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͭ������ | B����ͭ���� |
| C��ͭ������ | D����ͭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ�к��м�Ԫ��,ֻ�辭�������仯�Ϳ��Եõ��ص��� |
| B����ˮ�����ƴ��εĹ�����ֻ�����˻�ѧ�仯 |
| C����ҵ�Ͽ��õ��MgCl2��Һ�ķ������Ʊ�Mg |
| D���Ӻ�ˮ�п��Եõ�NaCl���������NaCl���Ʊ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ʡ���ά�����ǡ�����ϩ�����۶��Ǹ߷��ӻ����� |
| B�������Ҵ����ͣ�����������һ���������Ҵ������������Խ��ͻ�������β�����к������ŷ� |
| C��ʹ��̫������ˮ�������������á��������Ҵ����漰���������ܵ����� |
| D��ʯ�͡�ú����Ȼ������ȼ����ֲ���Ͷ����ڻ�ʯȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ӻ�ˮ�пɵõ�NaCl���������NaCl����ˮ��Һ�����Ƶ�Cl2 |
| B����ˮ�к���þԪ�أ��ʲ��辭����ѧ�仯�Ϳ��Եõ�þ���� |
| C����������ԭ���Ӻ�ˮ����ȡ��ˮ�Ǻ�ˮ����������չ���·��� |
| D�������Ǻ�ˮ���˷��绹�dz�ϫ���磬���ǽ���ѧ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
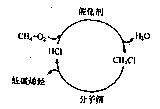
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com