
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需 时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<” ,“>” ,“=”)。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 mo1/L 。
(共15分)
(1) 5、4、6、5、4、2、6(2分)
(2)①1/6或0.17(2分) ②<1 (填0<a/b<1亦可)(2分) ③< (2分)
(3)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=﹣442.8 kJ∕mol (3分)
(聚集状态没注明不得分,未配平不得分)
(4)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-)(2分);(5)1.12×10— 4mo1/L (2分)
【解析】
试题分析:
(1)反应中C→CO2,碳元素化合价由0价升高为+4价,共升高4价,KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为20,故C的系数为5,故KMnO4系数为4,结合原子守恒配平后方程式为:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
(2)①、平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)=CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=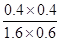 =0.17,
=0.17,
②、由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等。要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b的值小于1,
③、由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=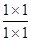 =1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
=1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,在该溶液中,直接电离出的Na+和HC2O4-浓度最大,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,所以c(Na+)>c(HC2O4-),c(H+)>c(OH-),溶液中水电离生成氢离子,故c(H+)>c(C2O42-),溶液呈酸,电离产生的c(C2O42-)原大于c(OH-),溶液中离子浓度c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
(5)Na2CO3溶液的浓度为1×10-4mo1/L,等体积混合后溶液中
c(CO32-)= ×1×10-4mo1/L=5×10-5mo1/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)=
×1×10-4mo1/L=5×10-5mo1/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)=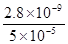 mol/L=5.6×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×5.6×10-5mol/L=1.12×10-4mol/L。
mol/L=5.6×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×5.6×10-5mol/L=1.12×10-4mol/L。
考点定位:本题考查氧化还原反应配平、平衡常数的计算与运用、热化学方程式书写、离子浓度大小比较、溶度积的有关计算等,题目综合性较大,是对学生能力的考查,难度中等,(5)中计算为易错点,溶液忽略混合后溶液的浓度发生变化。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:填空题
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
① 实验2条件下平衡常数K=??????? ??? 。
② 实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正???? V逆(填“<” ,“>” ,“=”)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?? ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g)?? ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l)?? ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系??????????????? ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为??????? _______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:????????? 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
 CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol 
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2 (g)+CO2 (g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
| NO | N2 | CO2 | ||
| 0 | 1.00 | 0 | 0 | ||
| 10 | 0.58 | 0.21 | 0.21 | ||
| 20 | 0.40 | 0.30 | 0.30 | ||
| 30 | 0.40 | 0.30 | 0.30 | ||
| 40 | 0.32 | 0.34 | 0.17 | ||
| 50 | 0.32 | 0.34 | 0.17 |
①0min~10min以v(CO2) 表示的反应速率为 。
②下列各项能作为判断该反应达到平衡的是 (填序号字母)。

A.容器内压强保持不变
B. 2v(NO)(正)= v(N2)(逆)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
③30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。如图表示CO 2的逆反应速率[v逆(CO 2)]随反应时间(t)的变化关系图。请在图中画出在30min改变上述条件时在40min 时刻再次达平衡的变化曲线。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol K1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol K2
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式 (写成最简整数的形式),并用K1和K2表示该反应的平衡常数K

(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。右图为,H2CO3在通入HCl或加入氢氧化钠固体后,平衡时溶液中三种成分的pC—pH图。由图可知:若往碳酸钠溶液加入盐酸至pH约为 时有CO2气体放出 , 若往0.001mol/L通入HCl至图中A点(为两曲线的交点,纵坐标约为3.3)时溶液中所有离子浓度从大到小关系是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com