
| A. | NaOH | B. | Na2O2 | C. | H2O2 | D. | NH4Cl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.NaOH是离子化合物,钠离子和氢氧根离子之间形成的是离子键,氢氧根离子中氢原子与氧原子之间形成的是极性共价键,故A错误;
B.Na2O2是离子化合物,钠离子和氢氧根离子之间形成的是离子键,过氧根离子中氧原子与氧原子之间形成的是非极性共价键,故B正确;
C H2O2是共价化合物,只含有共价键,故C错误;
D NH4Cl是离子化合物,铵根离子和氯离子之间形成的是离子键,铵根离子中氢原子与氮原子之间形成的是极性共价键,故D错误;
故选B.
点评 本题考查化学键,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,知道常见物质中存在的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 烧杯中有Fe无Cu | B. | 烧杯中有Cu无Fe | C. | 烧杯中Fe、Cu都有 | D. | 烧杯中Fe、Cu皆无 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na2O2的电子式
,Na2O2的电子式
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硫酸代替稀硫酸可以加快和锌反应制取氢气的速率 | |
| B. | 在合成氨反应中,增大N2浓度可以使H2的转化率达到100% | |
| C. | 当可逆反应达到化学平衡状态时,正逆反应速率均为零 | |
| D. | 用锌粉代替锌块与稀硫酸反应可以加快制取氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | N、O、F元素最高正化合价依次升高 | |
| C. | P、S、Cl原子半径依次增大 | |
| D. | Na、K、Rb的第一电离能依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 4 v(O2)=5 v(NO) | D. | 2 v(NH3)=3 v(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入足量稀硝酸无明显现象,再加硝酸银溶液产生白色沉淀,一定有Cl- | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氯水,再加KSCN溶液显红色,一定有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 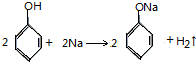 | B. | 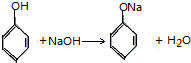 | ||
| C. | 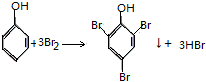 | D. | 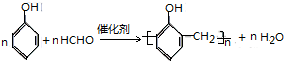 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com