
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol
0~4min时,容器气体压强为101KPa。反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
回答下列问题:
(1)①______________时,反应处于平衡状态。
②第5min时,从速率和转化率两个方面分析,改变的外界条件是________;平衡向_____方向移动。
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的变化曲线如图。
的值,与SO2平衡时的体积百分含量的变化曲线如图。

在图中画出在相同压强下,温度为400℃时,起始O2和SO2的物质的量之比![]() 的值,与SO2平衡时的体积百分含量的大致变化曲线。
的值,与SO2平衡时的体积百分含量的大致变化曲线。
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L1的H2C2O4溶液滴加0.01mol•L1KOH溶液V(mL),回答下列问题。
①当V<10mL时,反应的离子方程式为 。
②当V=10mL时,溶液中HC2O4、C2O42、H2C2O4、H+的浓度从大到小的顺序为
。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42)+c(HC2O4);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42)+c(HC2O4)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。
科目:高中化学 来源: 题型:阅读理解
 ),有关反应如下:
),有关反应如下:| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0. CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
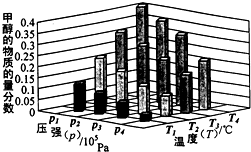 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)=CH3OH(g)
请根据下图回答下列问题:
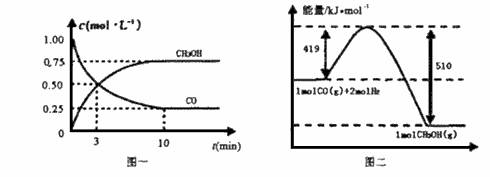
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= 。
(2)写出该反应的热化学方程式 。
n(CH3OH)
(3)恒容条件下,下列措施中能使 n(CO) 增大的有 。
A.升高温度 B.充入He气 C.再充入1 mol CO和2 mol H2 D.使用催化剂
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化(Q1、Q2、Q3均大于0) |
| 甲 | 1 mol CO和2 mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1 mol CH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2mol CO和4 mol H2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是:
A. c1=c2 B.2Q1=Q3 …… C.2a1=a3 D. a1+ a3=1
E.该反应若生成1 mol CH3OH,则放出(Q1+ Q2)kJ热量
(5)若在一体积可变的密闭容器中充入1 mol CO、2 mol H2和1 mol CH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com