
分子式为 C5H8O2的有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有
A.8 种 B.10 种 C.11 种 D.12 种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年吉林省松原市高一下期中化学试卷(解析版) 题型:选择题
下列叙述中说明某化学平衡一定发生移动的是
A.混合体系中气体密度发生变化
B.正、逆反应速率改变
C.混合物中各组分的浓度改变
D.反应物的转化率改变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月调研二化学试卷(解析版) 题型:实验题
1,2一二溴乙烷可作抗爆剂的添加剂。下图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴(表面覆盖少量水)。

已知:
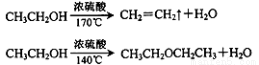
相关数据列表如下:
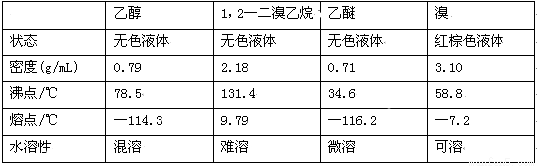
(1)实验中应迅速将温度升高到170℃左右的原因是 。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象 ;安全瓶b还可以起到的作用是 。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是 。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月调研二化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.聚丙烯的结构简式为:
B.丙烷分子的球棍模型为: 
C.四氯化碳分子的电子式为: 
D.TNT的结构简式为:
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前押题理综化学试卷(解析版) 题型:填空题
今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g) 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
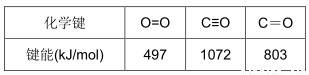
则反应:2NO(g)+2CO(g) 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
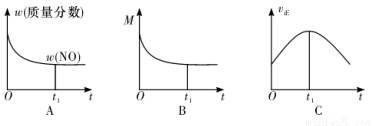
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g) 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:
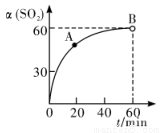
则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。
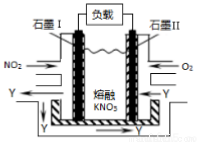
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下第四次月考化学试卷(解析版) 题型:填空题
氟及氟产品在工农业生产中应用非常广泛,回答下列问题:

(1)基态氟原子核外电子的运动状态有_______种,这些电子的电子云形状有______种;氟原子的外围电子排布式为______________;
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有______________;与HF2-互为等电子体的分子有______________;(举一例).
(3)N2F2(二氟氮烯)分子中,氮原子的杂化轨道类型为_____________,画出N2F2可能的结构式______;
(4)三氟化硼乙醚(如图1)的熔点为-58℃,沸点为126~129℃,它属于____________晶体.
(5)氟化钙的晶胞结构如图2所示,晶胞参数α=0.555pm.
①Ca2+、F-的配位数分别为_______和_____;
②列式表示氟化钙晶体的密度______________g•cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下第四次月考化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。
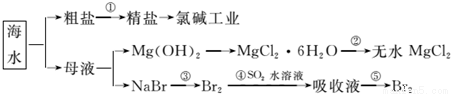
下列有关说法正确的是( )
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.工业上通过氯碱工业制取金属钠
C.从第③步到第⑤步的目的是浓缩、富集溴单质
D.第②步的反应条件是高温加热
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下第二次月考化学试卷(解析版) 题型:填空题
(1) CO2的电子式为_______;属于______化合物(填“共价”或“离子”);
(2) H2O2的结构式为________,属于 分子(填“极性”或“非极性”);
(3) SO42-中S原子的杂化方式为 ,该微粒的空间构型为 ;
(4) 甲元素: 违背了_______;
违背了_______;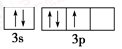 违背了________;
违背了________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州凯里一中高一下期中理科化学试卷(解析版) 题型:选择题
一定条件下,在容积固定的某密闭容器中发生反应N2+3H2 2NH3。在10s内N2的浓度由5mol/L降至4mol/L,下列说法正确的是( )
2NH3。在10s内N2的浓度由5mol/L降至4mol/L,下列说法正确的是( )
A.用NH3表示的化学反应速率为0.1 mol/(L·s)
B.使用合适的催化剂,可以加快该反应的速率
C.增加H2的浓度或降低温度都会加快该反应的速率
D.反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com