
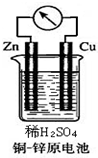
 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:分析 铜、锌、稀硫酸构成的原电池中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答 解:铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+,锌片逐渐溶解;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,若有0.2摩尔电子转移,依据电极反应计算得到生成氢气物质的量为0.2mol,
①铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,
故答案为:有气泡生成;
②铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+,锌片逐渐溶解;铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;
③若生成的氢气在标况下的体积为4.48L,氢气的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,所以有0.2×2mol电子转移,原电池加快反应速率;
故答案为:0.4;要快.
点评 本题考查了原电池原理,明确正负极上得失电子、反应类型、电极反应式的书写即可解答,难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有酸和碱之间的中和反应 | |
| B. | 所有强酸和强碱之间的中和反应 | |
| C. | 所有可溶性酸和可溶性碱之间的中和反应 | |
| D. | 强酸溶液与强碱溶液生成可溶性盐和水的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
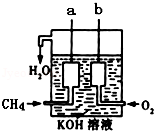 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的化学方程式是:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-889.6kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
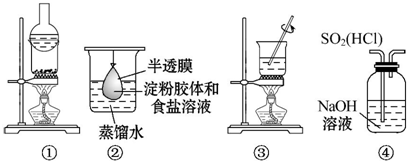
| A. | 用①分离氯化铵和单质碘 | |
| B. | 用②除去淀粉溶液中的氯化钠 | |
| C. | 用③加热胆矾(CuSO4•5H2O)制取无水硫酸铜 | |
| D. | 用④装置除去SO2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
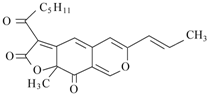 红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用.其中一种成分--红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )| A. | 分子中环上的所有原子都在同一平面上 | |
| B. | 红斑红素的分子式为C21H24O5 | |
| C. | 1 mol该物质能与5 mol Br2发生加成反应 | |
| D. | 1 mol 该物质水解时能消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
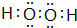 ,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).
,并指明A2C2分子中化学键的类型共价键(或极性共价键和非极性共价键).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com