
| A、催化剂V2O3不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
| c2-c1 |
| t2-t1 |


科目:高中化学 来源: 题型:
| A、1 L生理盐水(0.9% NaCl溶液)中含有9 mol Na+ |
| B、金属钠着火,可用干燥沙土盖灭 |
| C、浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 |
| D、氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
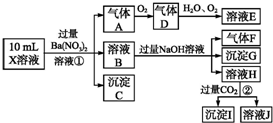
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
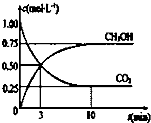 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.| c(CH3OH) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 出现环境 | 实验事实 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 用惰性电极电解CuCl2溶液 | 在阳极有红色固体物质析出 |
| C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
| D | 将钢闸门与外加电源正极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、镀锌的铁比镀锡的铁耐用 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、铝片不用特殊方法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成原子个数比为1:1的化合物只有两种 |
| B、Y、W的氧化物均为酸性氧化物 |
| C、最高价氧化物对应水化物的酸性Y<W |
| D、X与Z形成的化合物中,各原子均满足8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com