
某硝酸盐晶体化学式为M(NO3)x·nH2O,式量为242,将1.21 g该晶体溶于水配成100 mL溶液,用惰性电极进行电解;当有0.01 mol电子转移时,溶液中金属离子全部析出,此时阴极增重0.32 g.求:
(1)金属M的相对原子质量及x、n的值;
(2)电解后溶液的pH.
科目:高中化学 来源:2012-2013学年广东省梅州市高三总复习质检二理综化学试卷(解析版) 题型:实验题
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
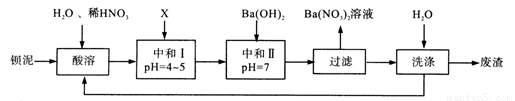
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)最后的废渣中除原有的难溶性杂质外还含有 (填化学式)。
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为 。(已知Ba(NO3)2、BaSO4的式量分别为261、233)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com