

| A. | 元素的简单离子半径M<W<Z | |
| B. | Y元素在自然界存在多种同素异形体 | |
| C. | 最高价氧化物的水化物酸性W>N | |
| D. | N与Z的质子数之差为16 |
分析 由元素在周期表中的位置可知X、Y、Z、W、M、N分别为He、C、K、Cl、S、Br等元素,
A.核外电子排布相同的离子,核电荷数越大离子半径越小;
B.Y为C元素,存在金刚石、石墨等同素异形体;
C.元素的非金属性越强,对应的最高价氧化物的水化物酸性越强;
D.Z的质子数为19,N的质子数为35.
解答 解:由元素在周期表中的位置可知X、Y、Z、W、M、N分别为He、C、K、Cl、S、Br等元素,
A.Z、W、M对应的离子具有核外电子排布相同的离子,核电荷数越大离子半径越小,故A错误;
B.Y为C元素,存在金刚石、石墨等同素异形体,故B正确;
C.非金属性W>N,元素的非金属性越强,对应的最高价氧化物的水化物酸性越强,故C正确;
D.Z的质子数为19,N的质子数为35,质子数之差为16,故D正确.
故选A.
点评 本题考查了元素周期表和元素周期律的综合应用,为高频考点,根据元素周期律中电负性大小、原子结构、非金属性强弱等规律来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
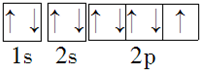 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml)[来 | 5 | 11 | 7 | 8[ | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子半径大小呈周期性变化 | |
| B. | 元素原子量依次递增 | |
| C. | 元素的最高正化合价呈周期性变化 | |
| D. | 元素原子最外层电子排布呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com