
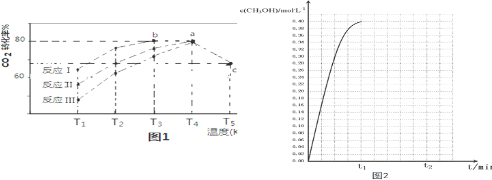
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
分析 (1)根据有机物羟基与活泼金属的反应原理:2CH3OH+2Na→2CH3ONa+H2↑;
(2)焓变的计算式有两种计算式,一种是△H=E(生成物总能量)-E(反应物总能量),另一种是△H=E(反应物的键能)-E(生成物的键能)
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1,已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1
△H=E(反应物的键能)-E(生成物的键能)=2E(C═0)+3E(H-H)-3E(C-H)-E(C-O)-E(H-O)-2E(H-O)=2×803kJ•mol-1+3×436kJ•mol-1-3E(C-H)-326kJ•mol-1-464kJ•mol-1-2×464kJ•mol-1=-46kJ•mol-1 可得:E(C-H)=414kJ•mol-1.
(3)A.由ρ(混合气体)=$\frac{m(混合气体)}{V}$知,密闭容器中m(混合气体)和v都不变,比值不变,即ρ(混合气体)不变,故密度不再改变不能达到平衡状态;
B,(1)直接标志:①速率关系:正反应速率与逆反应速率相等;②反应体系中各物质的百分含量保持不变.(2)间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变.故CO2的体积分数保持不变时,即反应体系中CO2的百分含量保持不变,达到平衡状态;
C、平衡常数只与温度有关,该反应的温度变化,所以平衡常数也变化,所以平衡常数能判断达到平衡状态;
D、平均相对分子质量不变,由M(混合气体)=$\frac{m(混合气体)}{n(混合气体)}$,密闭容器中m(混合气体)不变,而n(混合气体)向正反应方向移动时减小,向逆反应方向移动时增大,故混合气体的平均相对分子质量不变,平衡不移动,能达到平衡状态;
(4)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,故催化剂效果最佳的反应是反应Ⅰ;②T3的b点时,反应已达到限度,故v(正)=v(逆);③原因是:T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低.故T4的a点转化率比T5的c点高;
④在温度为T5时,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.6 1.8 0 0
转化(mol/L):$0.6×\frac{2}{3}$ $0.6×\frac{2}{3}×3$ $0.6×\frac{2}{3}$ $0.6×\frac{2}{3}$
平衡(mol/L):0.2 0.6 0.4 0.4
在温度为T5时,该反应的平衡常数K=$\frac{C(C{H}_{3}OH)C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$=$\frac{0.4×0.4}{0.2×0.{6}^{3}}$=3.70.
解答 解:(1)根据有机物中羟基与活泼金属的反应原理:2CH3OH+2Na→2CH3ONa+H2↑,故答案为:2CH3OH+2Na→2CH3ONa+H2↑;
(2)△H=E(反应物的键能)-E(生成物的键能)
-46kJ•mol-1=2E(C═0)+3E(H-H)-3E(C-H)-E(C-O)-E(H-O)-2E(H-O)
=2×803kJ•mol-1+3×436kJ•mol-1-3E(C-H)-326kJ•mol-1-464kJ•mol-1-2×464kJ•mol-1
可得:E(C-H)=414kJ•mol-1,故答案为:414;
(3)A.由ρ(混合气体)=$\frac{m(混合气体)}{V}$知,密闭容器中m(混合气体)和v都不变,比值不变,即ρ(混合气体)不变,密度不再改变不能达到平衡状态,故A不正确;
B.O2的体积分数保持不变时,即反应体系中CO2的百分含量保持不变,达到平衡状态,故B正确;
C、平衡常数只与温度有关,该反应的温度变化,所以平衡常数也变化,所以平衡常数能判断达到平衡状态,故C正确;
D、平均相对分子质量不变,由M(混合气体)=$\frac{m(混合气体)}{n(混合气体)}$,密闭容器中m(混合气体)不变,而n(混合气体)向正反应方向移动时减小,向逆反应方向移动时增大,故混合气体的平均相对分子质量不变,平衡不移动,能达到平衡状态,故D正确;
故选:BCD;
(4)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ,故答案为:Ⅰ;
②T3的b点时,反应已达到限度,故v(正)=v(逆),故答案为:=;
③T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低.T4的a点转化率比T5的c点高.
故答案为:T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低.
④在温度为T5时,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):0.6 1.8 0 0
转化(mol/L):$0.6×\frac{2}{3}$ $0.6×\frac{2}{3}×3$ $0.6×\frac{2}{3}$ $0.6×\frac{2}{3}$
平衡(mol/L):0.2 0.6 0.4 0.4
在温度为T5时,该反应的平衡常数K=$\frac{C(C{H}_{3}OH)C({H}_{2}O)}{C(C{O}_{2}){C}^{3}({H}_{2})}$=$\frac{0.4×0.4}{0.2×0.{6}^{3}}$=3.70.
故答案为:3.70.
点评 考查用“三段式“进行化学平衡常数的计算;化学平衡状态的特征判断;焓变的计算;注意化学平衡状态标志的间接判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的共价化合物 | |
| B. | X,Y、Z可以组成一种盐,其中X、Y、Z元素原子个数比为4:2:3 | |
| C. | Y和W组成的化合物与X和Z组成的化合物反应可生成2种碱性物质 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
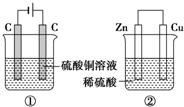 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入19.6gCu(OH)2固体,溶液恰好能恢复到电解前的浓度和体积.若忽略溶液体积的变化,则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

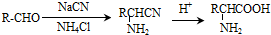
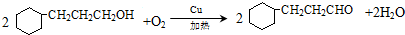 .
.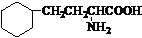 .写出满足下列条件的苯丙氨酸同分异构体的结构简式
.写出满足下列条件的苯丙氨酸同分异构体的结构简式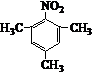 、
、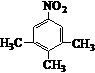 .
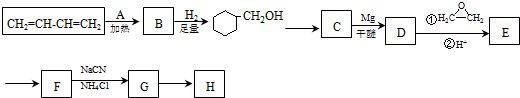
.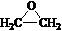 )制备1,4-戊二烯的合成路线(无机试剂任选).
)制备1,4-戊二烯的合成路线(无机试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com