
分析 (1)发生的反应为:CH4+4CuO=CO2↑+2H2O↑+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻4.8g,可知减少的质量为氧元素的质量,利用差量法计算甲烷的物质的量;
(2)根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,将反应后气体通入足量澄清Ca(OH)2溶液,充分吸收,生成的9g沉淀为CaCO3,根据n=$\frac{m}{M}$计算碳酸钙的物质的量,可知反应后的二氧化碳总的物质的量,根据甲烷的物质的量计算反应生成的二氧化碳的物质的量,进而计算原混合气体中二氧化碳的物质的量;然后根据气体总物质的量、甲烷的物质的量、二氧化碳的物质的量计算出氮气的物质的量,最后根据m=nM计算出氮气的质量.
解答 解:(1)设甲烷的物质的量为x,当甲烷完全反应后,硬质玻璃管的质量减轻4.8g,减少的质量为氧元素的质量,则:
CH4+4CuO=CO2+2H2O+4Cu 质量减轻△m
1mol 16×4g
x 4.8g,
解得:x=$\frac{4.8g×1mol}{64g}$=0.075mol,
答:原混合气体中甲烷的物质的量为0.075mol;
(2)混合气体的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
将反应后气体通入过量澄清Ca(OH)2溶液,充分吸收,生成9g沉淀是CaCO3,碳酸钙的物质的量为:$\frac{9g}{100g/mol}$=0.09mol,故反应后的二氧化碳总的物质的量为0.09mol,甲烷反应生成的二氧化碳的物质的量为0.075mol,故原混合气体中二氧化碳的物质的量为:0.09mol-0.075mol=0.015mol,
原混合气体中氮气的物质的量为:0.1mol-0.075mol-0.015mol=0.01mol,质量为:28g/mol×0.01mol=0.28g,
答:原混合气体中氮气的质量是0.28g.
点评 本题考查了混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{2a}{3V}$mol/L | B. | $\frac{a}{3V}$mol/L | C. | $\frac{a}{6V}$mol/L | D. | $\frac{a}{4V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
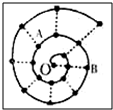 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com