
在372K时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B. 在2s时体系内压强为开始时的1.1倍
C. 在平衡时体系内含有N2O40.25mol
D. 平衡时,N2O4的转化率为40%
B
【解析】N2O4和NO2存在如下转化关系N2O4 2NO2,前2s时
2NO2,前2s时
N2O4  2NO2
2NO2
起始(mol) 0.5 0
反应(mol) 0.05 0.02×5
2s时(mol) 0.5-0.05 0.02×5
v(N2O4)=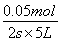 =0.005mol·L-1·s-1
=0.005mol·L-1·s-1
气体总的物质的量为0.5mol-0.05mol+0.02mol·L-1×5L=0.55mol。
2s时与开始的压强之比为p(2s)∶p(始)=0.55∶0.5=1.1∶1。
60s达到平衡时,设参加反应的N2O4的物质的量为x。则有
N2O4 2NO2
2NO2
起始(mol) 0.5 0
反应(mol) x 2x
平衡(mol) 0.5-x 2x
平衡时,气体总的物质的量为0.5mol-x+2x=0.5mol+x,所以有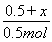 =1.6,解得x=0.3mol。
=1.6,解得x=0.3mol。
平衡体系中含0.2molN2O4,N2O4的转化率为 ×100%=60%。
×100%=60%。


科目:高中化学 来源:2014年高一化学人教版必修二 3-2-2苯练习卷(解析版) 题型:实验题
实验室制取硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合液,加入反应器。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直到反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸和浓硝酸混合酸时,操作注意事项是__________________________________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是______________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是_________________________。
(5)纯硝基苯是无色、密度比水________(填“大”或“小”),具有________气味的油状液体。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 3-1-2烷烃练习卷(解析版) 题型:选择题
下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或若干个“CH2”原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A.①②③④ B.只有②③ C.只有③④ D.只有①②③
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 3-1-1甲烷练习卷(解析版) 题型:选择题
2009年9月28日,中科院院士戴金星又宣布了一个新发现,他认为,多年来被社会流传甚广的“百慕大三角”现象,很有可能是海底储存的大量可燃冰在“捣鬼”。根据所学知识,判断下列推理正确的是( )
①“可燃冰”又称天然气水合物,遇火即可燃烧
②海底储存的大量可燃冰如果在压力减小、温度升高的条件下,就有可能融化成甲烷,甲烷升到海面上,会形成大量的气泡,从而产生“巨浪”。同时,海水的密度也会降低,船只经过自然会下沉
③“可燃冰”是一种有待开发的新能源,作为燃料,它不会产生温室气体
A.仅有① B.仅有①② C.仅有①③ D.全都正确
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 3-1-1甲烷练习卷(解析版) 题型:选择题
下列关于甲烷的叙述正确的是( )
A.甲烷分子的空间构型是正四面体,所以,CH2Cl2有两种不同构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
D.甲烷能使KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 2-3-2化学反应的限度练习卷(解析版) 题型:选择题
2SO2(g)+O2(g)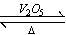 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.升高反应体系的温度,反应速率一定增大
C.因该反应是放热反应,所以降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,O2(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=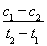
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 2-3-1化学反应速率练习卷(解析版) 题型:填空题
用纯净的碳酸钙和稀盐酸反应制取二氧化碳气体,请回答:

(1)实验过程如图所示,分析判断:__________段化学反应速率最快,________段收集的二氧化碳气体最多。
(2)为了减缓上述反应的化学速率,欲向溶液中加入下列物质,你认为可行的是________(填字母编号)。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 2-2-2发展中的化学电源练习卷(解析版) 题型:填空题
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④
C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使1 m2面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为______________________。
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 2-1化学能与热能练习卷(解析版) 题型:选择题
下列说法正确的是( )
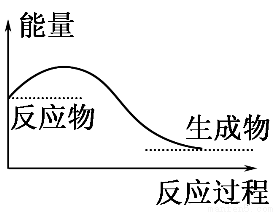
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)的过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.如图所示的是吸收能量的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com