
 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( ) | A. | ①②③ | B. | ①③ | C. | ①② | D. | ② |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.
小明按图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
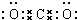 .
.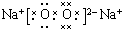 ,其存在的化学键是离子键和非极性键
,其存在的化学键是离子键和非极性键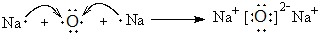 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ④表示的是阳离子 | |
| B. | ?①③属于同种元素,?②④属于另一种元素 | |
| C. | ?②④形成的化合物是Al2O3 | |
| D. | ①③的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com