
【题目】在实验室中,下列除杂的方法正确的是( )
A. 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴
B. 乙烷中混有乙烯,通过酸性KMnO4溶液的洗气瓶
C. 苯中混有苯酚,将其倒入NaHCO3溶液中,静置,分液
D. 乙醇中混有乙酸,加入CaO固体后蒸馏收集乙醇
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A. d元素的基态原子的核外电子的运动状态有17种
B. 它们均存在两种或两种以上的氧化物
C. b与c或d形成的化合物都是良好的有机溶剂
D. b、c、d与氢形成的化合物中化学键均为极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中,所选取的分离装置与对应原理都正确的是 ( )

选项 | 目 的 | 装置 | 原 理 |
A | 氢氧化铁胶体的纯化 | ① | 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸 |
B | 分离苯中的溴苯 | ③ | 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同 |
C | 粗盐提纯 | ①② | NaCl在水中的溶解度很大 |
D | 除去环己醇中的环烯 | ④ | 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
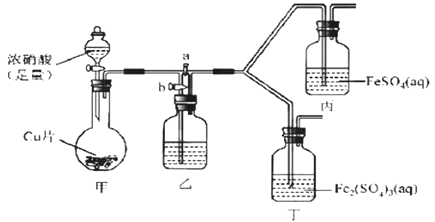
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,缩小体积,平衡右移,SO2浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸 (浸有氯化钯洛液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMn04 溶液的滤纸,a和b分别为两个小气球。

实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛有浓硫酸的仪器名称为________。待上述反应结束后,点燃酒精灯并在②号和③号滤纸的玻璃管近均匀加热,观察到的现象是_______。
(2)B瓶中酸性KMnO4溶液的作用是______________,发生反应的离子方程式为_____。
(3)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有______的滤纸(从以下试剂中选择)。
A.品红浓液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(4)若反应生成的两种碳的氧化物在相同条件下的体积比为2:1,则滤纸炭化后体积膨胀发生反应的化学方程式可能为_________。(若是氧化还原反应,请用单线桥法在化学反应方程式上标明电子转移的方向和数目。)
(5)若在尾端没有气球b,会有什么不良结果?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnCl4是一种重要的工业原料,常作媒染剂等。已知SnCl4常温下是无色液体,在潮湿空气中易水解,熔点-36℃,沸点114℃。工业上制备SnCl4的工艺流程如下:

请回答下列问题:
(1)粗锡电解精炼时,常用硅氟酸(化学式为H2SiF6)和硅氟酸亚锡(化学式为SnSiF6)为电解液。已知H2SiF6为强酸,则用硅氟酸溶解氧化亚锡的离子方程式为______。硅氟酸有腐蚀性,能与SiO2反应。电解时可选取下列电解槽中的________。
a.玻璃电解槽 b.不锈钢电解槽 c.塑料电解槽
阴极发生的电极反应式为_________。
(2)某同学模拟工业制法设计了由Sn与Cl2反应制取SnCl4的实验装置如下:

①a中浓盐酸与烧瓶内固体反应生成Cl2,则烧瓶内固体可以选用_________;仪器b的名称为_________。
②装置D的主要缺点是___________;除此之外,整套装置还有的缺点是_______。
③SnCl4溶液中加入适量的NaOH溶液,产生白色沉淀(二元酸),再加过量的NaOH溶液,白色沉淀溶解。试写出反应生成白色沉淀的离子方程式_________。
④若实验中取用锡粉5.95 g,反应后,E中广口瓶里收集到12.0 g SnCl4。则SnCl4的产率为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com