
【题目】新能源的开发利用时人类社会可持续发展的重要课题。下列属于新能源的是
A. 氢气 B. 煤炭 C. 天然气 D. 石油
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国市售加碘食盐中含有碘酸钾。已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
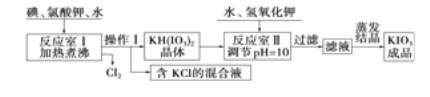
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
KCl | KH(IO3)2 | KClO3 | |
溶解度g/100 g水(25 ℃) | 20.8 | 0.8 | 7.5 |
溶解度g/100 g水(80 ℃) | 37.1 | 12.4 | 16.2 |
由上表数据分析可知,操作Ⅰ的名称为 、 。
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是
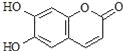
A. 与稀H2SO4混合加热不反应
B. 不能使酸性高锰酸钾溶液褪色
C. 1mol 瑞香素最多能与3mol Br2发生反应
D. 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
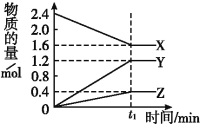
(1)该反应的化学方程式是 。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+2SO32-→I-+2SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)
④I2+SO32-+H2O→2I-+SO42-+2 H+(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。(填“①、②、③、④”)。
(2)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,才会使淀粉变蓝的现象产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等。
(1)以N2 和H2 为原料合成氢气为: N2(g) + 3 H2(g) ![]() 2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
(2)将体积均为560 mL(标准状况下)的SO2 和Cl2 同时缓慢通A水中,得到1.0 L溶液,则溶液pH=_______。
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3 溶液中,阴离子的电离程度较小的是__________(填化学式),原因是___________ 。
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是___________(填化学式,下同),阳极区放出的混合气体的成分为___________。
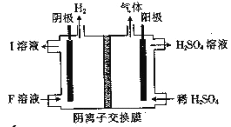
(5)氨水是一种常见的沉淀剂。向1.0 L 2.0×10—4molL—1的MgCl2 溶液中通入(不考虑溶液体积的变化),有白色沉淀生成。
①写出生成白色沉淀的离子方程式____________________.
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为___________mL。
(已知实验条件下NH3.H2O的电离平衡常数为1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)A中固体试剂是 ;B中所盛溶液溶质是 ;C中所盛溶液溶质是 (填字母)
a.醋酸钠 b.碳酸氢钠 c.苯酚钠 d.碳酸钠
(2)写出C中反应的离子方程式是: ;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为这种说法合理吗?说出你的理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不涉及化学变化的是
A.铁粉作袋装食品的抗氧化剂 B.二氧化硫作纸浆的漂白剂
C.氢氟酸作普通玻璃的刻蚀剂 D.有机溶剂作食用油的萃取剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com